
| A. | 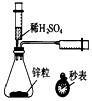 测定一定时间内生成H2的反应速率 | B. | 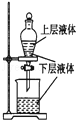 提取海带中的碘 | ||
| C. | 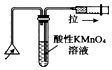 检验火柴燃烧产生的SO2 | D. | 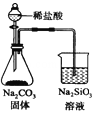 证明非金属性:Cl>C>Si |
分析 A.测定生成氢气的反应速率需要测定时间和收集气体体积;
B.海带中碘以离子的形式存在;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色;
D.生成的二氧化碳中含有HCl而干扰实验,元素的非金属性越强其最高价氧化物的水化物酸性越强.
解答 解:A.测定生成氢气的反应速率需要测定时间和收集气体体积,有测定体积的仪器和测定时间的仪器,所以可以实现实验目的,故A正确;
B.海带中碘以离子的形式存在,应先发生氧化还原反应后生成碘单质,再萃取、分液,故B错误;
C.二氧化硫具有还原性,能使高锰酸钾溶液褪色,图中试管中的导管长短应互换,故C错误;
D.盐酸具有挥发性,生成的二氧化碳中含有氯化氢,HCl也能和碳酸钠反应生成硅酸沉淀,所以干扰实验,且HCl不是氯元素的最高价氧化物是水化物,所以不能实现实验目的,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握速率测定、海水资源应用、非金属性比较及实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
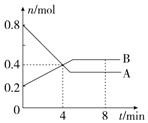 Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
Ⅰ.某温度时,在2L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4,酸性KMnO4溶液 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 澄清的石灰水,浓H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com