
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:

(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
【答案】1s22s22p63s23p4 N﹣H…N﹣或N﹣H…O﹣或 O﹣H…N﹣或O﹣H…O﹣ 变大 [Cu(NH3)4]SO4 中心原子与配体之间以配位键相结合,铜氨络离子与硫酸根离子之间以离子键相结合 ①③④ 3 2
【解析】
根据表中所给的信息,A基态原子有2个电子层,且最外层有3个未成对电子,则2p能级的3个轨道上分别有3个电子,即最外层有5个电子,为N元素;B基态原子,M层有1对成对电子,则3p能级有4个电子,为S元素;C基态原子核外电子排布及化合价可确定为Cu元素;
(1)B为S元素,其基态原子的核外电子排布式为:1s22s22p63s23p4;
(2)A为N元素,其氢化物为氨气,氨水中存在的氢键为:N﹣H![]() N﹣或N﹣H
N﹣或N﹣H![]() O﹣或O﹣H
O﹣或O﹣H![]() N﹣或O﹣H
N﹣或O﹣H![]() O﹣;孤电子对的排斥作用比成键电子对更强一些,氨气分子结合一个H+形成阳离子后,孤电子对转化为成键电子对,斥力减小,键角增大;
O﹣;孤电子对的排斥作用比成键电子对更强一些,氨气分子结合一个H+形成阳离子后,孤电子对转化为成键电子对,斥力减小,键角增大;
(3)向硫酸铜溶液中加入过量的氨水,则生成配合物,[Cu(NH3)4]SO4,中心原子Cu2+提供空轨道,氨分子给出孤电子对,以配位键形成[Cu(NH3)4]2+,再与SO42-以离子键结合;
(4)孤电子对数+中心原子的化学键个数为2,则sp杂化;为3,则sp2杂化;为4,则sp3杂化,答案为①③④;②的分子中有3个σ键和2个π键;答案为①③④;3;2


科目:高中化学 来源: 题型:
【题目】2018年7月5日《科学》杂志在线报道:美国研究人员合成一种新的具有超高热导率半导体材料一砷化硼(BAs)。回答下列问题:
(1)基态As原子价层电子的电子排布图(轨道表达式)为_____________,基态B原子核外电子占据最高能级的电子云轮廓图为_____________。
(2)通过反应4BI3(g)+As4(g)![]() 4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。
4BAs(s,晶体)十6I2(g)可制备BAs晶体,As4结构如图所示。

①BI3分子空间构型为____________,其中B原子杂化方式是____________________。
②As4分子中键角为____________度,分子中成键电子对与孤电子对数目之比为________________。

(3)晶态单质硼有多种结构,它们都以B12[结构如图所示]为基本的结构单元。B12结构单元为正_________面体。单质硼的熔点为2180℃,它属于_____________晶体。

(4)BAs晶胞结构如图所示,已知晶胞参数为0.4777nm,阿伏加德罗常数的值为NA。As原子的配位数为___________;BAs品体的密度为__________g·cm-1(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为____________________。
(3)元素C、D、E形成的简单离子半径大小关系是 ______>______>_____(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。C、D还可形成化合物D2C2,D2C2中含有的化学键是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是最常用的高效熏蒸杀虫剂,也是一种电子工业原料。
(1)PH3的电子式为______________。
(2)在密闭粮仓放置的磷化铝(AlP)片剂,遇水蒸气放出PH3气体,该反应的化学方程式为:_____。
(3)PH3的一种工业制法涉及的物质转化关系如下图所示:

①次磷酸属于____元酸,亚磷酸属于____元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3) =3:1时,参加反应的n(P4):n(NaOH)= ____。
(4)一种用于处理PH3废气的吸收剂成分为次氯酸钙80%、锯木屑(疏松剂)15%、活性炭 2.5%、滑石粉(防结块)2.5%。
①次氯酸钙将PH3氧化为H3PO4的化学方程式为_______________________________;
②空气中的水蒸气可加快PH3的氧化过程,其原因可能是_______________________。
(5)从(4)中的吸收残留物中回收磷酸氢钙(CaHPO4)的方法如下:

①试剂x为_________填化学式);
②已知25℃时,H3 PO4的Kal=7.5×10-3、Ka2=6.3×10-8、Ka3 =4.4×10-13。加入Y时,应控制悬浊液pH____7(填“>”、“=”或“<”),通过计算说明理由:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B. 由C(石墨)=C(金刚石) ΔH= +11.9 kJ/mol,可知金刚石比石墨稳定
C. 水力(水能)按不同的分类可看成可再生能源和一级能源
D. 表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 ( 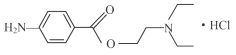 ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com