
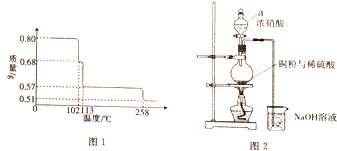
 硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:
硫酸在古代被称为“绿矾油”,唐代炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》中记有“炼石胆取精华法”即通过锻烧胆矾而获得硫酸的方法.请回答下列问题:分析 (1)纯净物只含有一种物质,混合物是由两种或者两种以上物质组成;
(2)由图分析可知,CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解;在200℃时失去的水的质量为0.80g-0.57g=0.23g,根据相应的化学方程式即可确定此时固体物质的化学式;
取270℃所得样品于一定温度下灼烧生成CuO、SO2、S03 和O2,若产物中S03和S02的质量之比为5:4,则其物质的量之比为1:1,设生成1mol二氧化硫,依据氧化还原反应得失电子守恒结合原子个数守恒书写方程式;
(3)①依据仪器形状说出其名称;依据分液漏斗使用方法可知:如果分液漏斗上口活塞小孔未与空气相通,则液体不会流出;反应生成的一氧化氮、二氧化氮有毒,直接排放到空气中会引起空气污染,需要进行尾气处理,二者能够与氢氧化钠反应生成亚硝酸钠而被吸收;
②根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离.
解答 解:(1)胆矾成分为CuSO4•5H2O,只含有一种物质属于纯净物,故答案为:纯净物;
(2)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
$\frac{250}{18n}$=$\frac{0.80}{0.23}$,解得n=4,
200℃时该固体物质的化学式为CuSO4•H2O;
取270℃所得样品于一定温度下灼烧生成CuO、SO2、S03 和O2,若产物中S03和S02的质量之比为5:4,则其物质的量之比为1:1,设生成1mol氧气,依据氧化还原反应得失电子守恒
则生成二氧化硫的物质的量为2mol,依据产物中S03和S02的质量之比为5:4,则其物质的量之比为1:1,生成三氧化硫为2mol,依据硫原子个数守恒硫酸铜物质的量为4mol,氧化铜物质的量为4mol,方程式:4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑;
故答案为CuSO4•H2O;4CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2SO2↑+2SO3↑+O2↑;
(3)①依据仪器a形状可知该仪器为:分液漏斗;依据分液漏斗使用方法可知:如果分液漏斗上口活塞小孔未与空气相通,则液体不会流出;反应生成的一氧化氮、二氧化氮有毒,直接排放到空气中会引起空气污染,需要进行尾气处理,二者能够与氢氧化钠反应生成亚硝酸钠而被吸收,所以氢氧化钠作用为:吸收尾气,防止污染空气;
故答案为:分液漏斗;上口的玻璃塞未打开(或凹槽未对准漏斗上的小孔);吸收尾气,防止污染空气污染;
②如果铜粉、硫酸及硝酸都比较纯净,则若硝酸过量会有硝酸铜生成,所以混有硝酸铜杂质,化学式:Cu(NO3)2;需利用溶解度的不同,用重结晶的方法进行分离,
故答案为:Cu(NO3)2;重结晶.
点评 本题考查化学实验,意在考查对化学实验原理、实验设计和实验结论的运用能力,涉及物质成分的判断,化学方程式的书写,仪器使用方法等,题目综合性较强,难度中等.


科目:高中化学 来源: 题型:实验题
| 实验编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴 0.1mol/L FeCl3 溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ②白色沉淀溶解,得无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| C. | 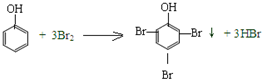 | |
| D. | CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 某物质做焰色反应时,火焰呈黄色,则该物质中肯定不存在钾元素 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和氢氧化铜 | B. | 硫酸和氢氧化钠溶液 | ||
| C. | 醋酸和氢氧化钡溶液 | D. | 稀硝酸和氨水混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com