
| A、①② | B、①③ | C、① | D、②③ |
科目:高中化学 来源: 题型:
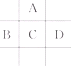 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NO2通入FeSO4溶液中不会有明显现象 |
| B、2L 0.5mol/L的盐酸和1L 0.5mol/L的硫酸PH相等 |
| C、饱和氯水中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下反应的△H不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0~t1时间内,v(Y)=
| ||
| C、M点的正反应速率V正大于N点的逆反应速率V逆 | ||
| D、M点时再加入一定量X,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B、2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C、加热0.1mol?L-1 Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D、对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
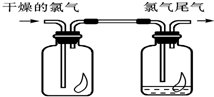 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
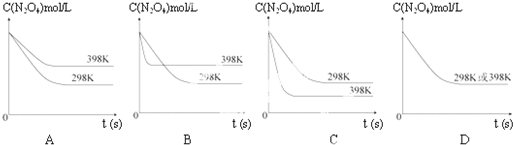
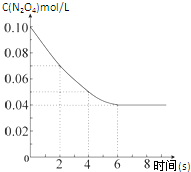 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com