
����Ŀ�����ڹ�ũҵ������Ӧ�ù㷺��
��1��������ͼд���ϳɰ����Ȼ�ѧ����ʽ��____________________��

��2����1mol N2��g����3mol H2��g������һ�ܱ������У����з�Ӧ����÷�Ӧ�ų�������______������ڡ��������ڡ���С�ڡ���92.2kJ��ԭ����______���������������H__________�����������䡱��С������
��3��N2H4����ΪNH3�����е�H����NH2ȡ���IJ����������ʱ��N2H4��g��Ϊȼ�ϡ�NO2Ϊ�����������߷�Ӧ����N2��H2O��g����
��֪��N2��g��+2O2��g���T2NO2��g����H1=+67.7kJmol��1
N2H4��g��+O2��g���TN2��g��+2H2O��g����H2=��534kJmol��1
��1mol N2H4��NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ______________________��
���𰸡� N2��g��+3H2��g��2NH3��g����H=��92.2kJ/mol С�� �÷�Ӧ�ǿ��淴Ӧ����Ӧ����ȫ��ת��Ϊ������ ���� N2H4��g��+NO2��g��=![]() N2��g��+2H2O��g����H=��567.85 kJmol��1
N2��g��+2H2O��g����H=��567.85 kJmol��1
����������1������ͼ���֪����1mol�����ų�46.1kJ���������Ժϳɰ����Ȼ�ѧ����ʽ��N2��g��+3H2��g��![]() 2NH3��g����H=��92.2kJ/mol����2�����ڸ÷�Ӧ�ǿ��淴Ӧ����Ӧ����ȫ��ת��Ϊ��������Խ�1mol N2��g����3mol H2��g������һ�ܱ������У����з�Ӧ����÷�Ӧ�ų�������С��92.2kJ����3����֪��
2NH3��g����H=��92.2kJ/mol����2�����ڸ÷�Ӧ�ǿ��淴Ӧ����Ӧ����ȫ��ת��Ϊ��������Խ�1mol N2��g����3mol H2��g������һ�ܱ������У����з�Ӧ����÷�Ӧ�ų�������С��92.2kJ����3����֪��
��N2��g��+2O2��g����2NO2��g����H1=+67.7kJmol��1
��N2H4��g��+O2��g����N2��g��+2H2O��g����H2=��534kJmol��1
����ݸ�˹���ɿ�֪�ڣ��١�1/2���õ�1mol N2H4��NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪN2H4��g��+NO2��g����3/2N2��g��+2H2O��g����H=��567.85 kJmol��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z�����ֶ�����Ԫ����X��Y����ͬһ������X��ԭ�ӽṹʾ��ͼΪ![]() ��Y2-��Z+��W3+�ĵ��Ӳ�ṹ��ͬ������˵������ȷ����
��Y2-��Z+��W3+�ĵ��Ӳ�ṹ��ͬ������˵������ȷ����
A. �����Ӱ뾶Y2->Z+>W3+
B. Y��Z�γɵĻ�����һ���������Ӽ�
C. W �ĵ����������������������ᷴӦ��������Ӧ
D. X��YԪ���γɵ�����X2Y42-���л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���NaBr��NaI����Һ��ͨ������Cl2��Ȼ�����Һ���ɣ��������ù������գ����ʣ���������
A.NaClB.NaCl��I2C.NaCl��NaBrD.NaCl��NaBr��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ȷ����
A. �ڴ��������װ��ͭ��ɷ�ֹ�䷢���绯ѧ��ʴ
B. MnO2��FeCl3��CuSO4���ɼӿ�H2O2�ķֽ�����
C. FeCl3��Һ��Fe2(SO4)3��Һ�������ɡ����ն��õ�Fe2O3
D. �ö��Ե缫�ֱ���CuCl2��Һ��MgCl2��Һ�ֱ�õ�����Cu��Mg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�����ķ����У�����ԭ�Ӷ�����ͬһƽ�����(����)
������ �ڼױ� �۷��� ��������ϩ
A.�٢�B.�٢�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鿴���о�����Ʒ�ı�ǩ�����оƾ�������ߵ���
A. ơ�� B. �� C. ���Ѿ� D. �ƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ�����������ڴ����а���ȼ�ա�����ijУ��ѧС��ѧ��������£�ͼ�����еȼг�װ������ȥ�����а����������ڲ�ͬ�����·�Ӧ��ʵ�飮 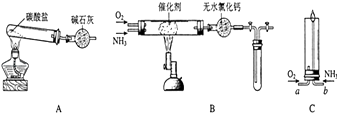
��1����װ��A��ȡ����������İ��������Թ���̼���εĻ�ѧʽ������ʯ�ҵ������� ��
��2���������İ��������������ͨ��װ��B������Ϊ��ʯ�ޣ��У��þƾ���Ƽ��ȣ����������Ļ�ѧ����ʽ�� ��
��3����������������A�����İ����ֱ��a��b���ܽ�����ͨ�뵽װ��C�У�����b���϶˵�ȼ������
��������ͨ����Ⱥ�˳�������������� ��
�ڰ���ȼ�յĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com