
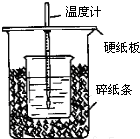
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态;
(6)根据弱电解质电离吸热分析;
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值△t,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×△t=418△tJ=0.418△t kJ,所以实验测得的中和热△H=-$\frac{0.418△t}{0.025}$kJ/mol;
故答案为:-$\frac{0.418△t}{0.025}$;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50mol•L-1盐酸代替H2SO4溶液进行上述实验,测得中和热数值相等;1molH2SO4溶液与NaOH溶液恰好完全反应时放热114.6kJ,则反应热化学方程式:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol;
故答案为:不相等;相等;H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol;
(6)NH3•H2O是弱电解质,电离过程为吸热过程,所以用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,反应放出的热量偏小,测得的中和热的数值会偏小;
故答案为:偏小;
点评 本题考查学生有关中和热的测定,题目难度中等,注意理解中和热的概念和测定原理是解题的关键.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
 如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )
如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )| 选项 | 气体 | 装置中药品 | ||
| a | b | C | ||
| A | C2H2 | 饱和食盐水+电石 | CuSO4溶液 | 溴水 |
| B | CO2 | 稀盐酸+石灰石 | 饱和NaHCO3溶液 | 苯酚的溶液 |
| C | C2H4 | 溴乙烷+NaOH乙醇溶液 | 水 | K2Cr2O7酸性溶液 |
| D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
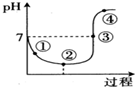 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A. | O2在石墨Ⅱ附近发生氧化反应放电时,NO3-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ极附近发生的反应:NO+O2+e-=NO3 | |
| C. | 电池的总反应式为:4NO2+O2=2N2O5 | |
| D. | 当外电路通过4mole-,负极上共产生2molN2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:
Na2CO3和NaHCO3与盐酸反应热效应的测定.按如图所示连接好装置,为探究NaHCO3、Na2CO3和盐酸反应过程中的热效应,进行实验并测得如下数据:| 序号 | 48mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
| ① | 水 | 2 g NaHCO3 | 20.0 | 18.6 |
| ② | 水 | 2 g Na2CO3 | 20.0 | 21.6 |
| ③ | 盐酸(0.1mol•L-1) | 2 g NaHCO3 | 20.0 | 17.2 |
| ④ | 盐酸(0.1mol•L-1) | 2 g Na2CO3 | 20.0 | 22.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.
(1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
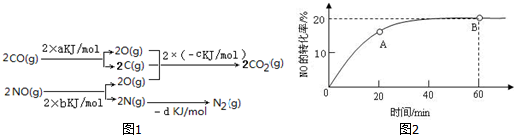
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com