
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g)
△H
2Fe(s)+3CO2(g)
△H
(1)已知:①Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
|
编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
|
① |
378 |
4 |
3∶1 |
实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
|
② |
378 |
4 |
4∶1 |
|
|
③ |
378 |
3 |
_______ |
|
|
④ |
398 |
4 |
4∶1 |
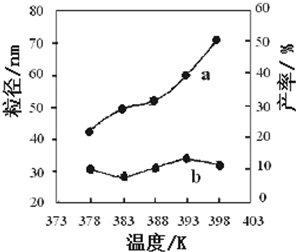
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。

(16分)I.(1)△H1 -3△H2(2分)
(2)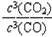 (3分) 注:用“[ ]”表示平衡浓度的也给分
(3分) 注:用“[ ]”表示平衡浓度的也给分
(3)①60%(2分) ②B(2分)
II. 4∶1(1分) 温度对产率的影响(2分) ③(1分)
在378~398K(1分),生成的纳米MgO的粒径大小无明显变化(合理则给分)(2分)
或者:在378K~398K(1分或在实验温度下也得分),随温度的升高,产率增大(2分)
383K较低温度下有利于形成较小的颗粒(3分)
注:填“在实验温度下”也得分。
【解析】
试题分析:(1)观察已知热化学方程式,根据盖斯定律,可以用①-②×3约去3C(石墨),得到高炉炼铁的反应式,则Fe2O3(s)
+ 3CO(g)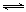 2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
2Fe(s)+3CO2(g)的△H =①的焓变-②的焓变×3=△H1 -3△H2;(2)根据平衡常数的概念,由于固体物质或纯液体的浓度是常数,不能写进表达式,则高炉炼铁的平衡常数K=c3(CO2)/c3(CO);(3)①起始时甲容器中c3(CO2)/c3(CO)=1.03/1.03=1<64,说明该反应一定从正反应方向开始进行,反应物浓度减小,生成物浓度增大,直到达到新的平衡,设CO的平衡转化率为x,则:
Fe2O3(s) + 3CO(g) 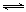 2Fe(s)
+ 3CO2(g)
2Fe(s)
+ 3CO2(g)
起始浓度/ mol·L-1 0.5 0.5
变化浓度/ mol·L-1 0.5x 0.5x
平衡浓度/ mol·L-1 0.5-0.5x 0.5+0.5x
K=c3(CO2)/c3(CO)=( 0.5+0.5x) 3/(0.5-0.5x)3=64
( 1+x) 3/(1-x)3=64,则( 1+x)/(1-x)=4,1+x=4-4x,5x=3,x=0.6或60%
②正反应是气态物质体积保持不变的反应,则反应前后气态物质的物质的量保持不变,则平衡前后气体的压强不变,故A错误;混合气体的密度=混合气体的总质量/容器的容积,由于反应物和生成物中都有固体物质参加,且平衡前混合气体的总质量会增大,只有平衡时混合气体的总质量才保持不变,密度才不变,故B正确;正反应是气态物质体积保持不变的反应,增大CO浓度必然同时增大压强,增大压强时该平衡不能移动,CO的转化率不变,故C错误;氧化铁的固体,其浓度是常数,增加氧化铁的量不能增大反应物浓度或压强,平衡不会移动,则CO的转化率不变,故D错误;(4)根据控制变量设计探究实验方案的原理可知,实验①和②探究的目的是反应物配比对纳米MgO产率的影响,实验②和④探究的目的是温度对纳米MgO产率的影响,实验②和③探究的目的是反应时间对纳米MgO产率的影响;读图可知,在378~398K,生成的纳米MgO的粒径大小无明显变化,或者在378K~398K(或在实验温度下),随温度的升高,产率增大,383K较低温度下有利于形成较小的颗粒。
考点:考查化学反应原理大题,涉及盖斯定律的应用、化学平衡常数及应用、平衡转化率的计算、化学平衡移动、设计几种因素影响产率的探究实验、解释化学平衡图像等知识。


科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com