

分析 (1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子发生氧化反应;
(2)根据串联电路中转移电子相等计算;
(3)根据“析出什么加入什么”的原则加入物质;
(4)F连接电源的负极,应为阴极,生成氢气,为阳极,阳极上生成氯气,电解氯化钠溶液生成氢气、氯气和氢氧化钠;
(5)由电极方程式CH4-8e-+10OH-=CO32-+7H2O,利用甲烷的量和转移电子的量之间的关系进行计算即可.
解答 解:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,
故答案为:CH4+10OH--8e-═CO32-+7H2O;
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.56L=560mL,
故答案为:560;
(3)乙池子电解硝酸铜,用活泼电极金属银为阳极,所以在阴极上是铜离子得电子生成金属铜的反应,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,
故选:A;
(4)F连接电源的负极,应为阴极,生成氢气,为阳极,阳极上生成氯气,电解氯化钠溶液生成氢气、氯气和氢氧化钠;电解氯化钠溶液的总反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:氢气;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(5)由电极方程式CH4-8e-+10OH-=CO32-+7H2O可知,若电池甲烷通入量为1 L(标准状况),电解池通过的电量为$\frac{1L}{22.4L/mol}$×8×9.65×104C•mol-1=3.45×104C,故答案为:3.45×104C.
点评 本题综合考查原电池、电解池的工作原理知识,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
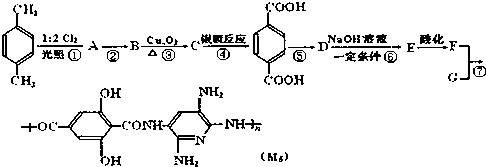
 ,
, ;F的含氧官能团的名称有羧基、(酚)羟基.
;F的含氧官能团的名称有羧基、(酚)羟基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
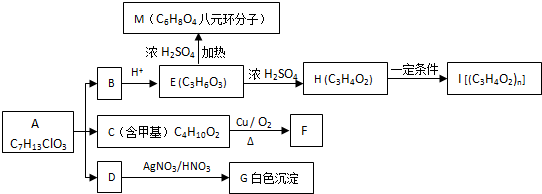

 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$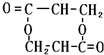 +2H2O;
+2H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
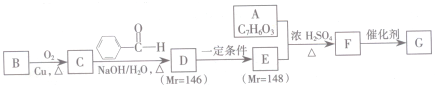

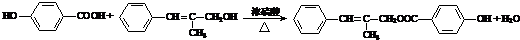 .
. .
. (其中任一种).
(其中任一种). 结构②苯环上有2个取代基.
结构②苯环上有2个取代基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. | 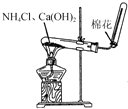 利用图所示装置制取NH3 | |
| C. |  利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
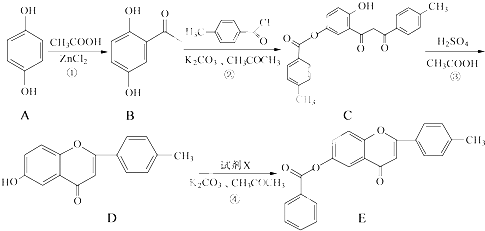
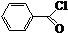 .
.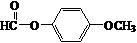 .
.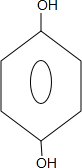 +CH3COOH$\stackrel{ZnCl_{2}}{→}$
+CH3COOH$\stackrel{ZnCl_{2}}{→}$ +H2O.
+H2O. .
.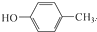 和CH3COOH为原料制备
和CH3COOH为原料制备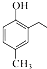 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com