
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.分析 (1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;
(2)利用氯气和氢氧化钠溶液反应来处理尾气;
(3)①石灰乳吸收工业氯气尾气制得漂白粉生成氯化钙、次氯酸钙;
②漂白粉的有效成分是(填化学式)是Ca(ClO)2 ;
③次氯酸钙Ca(ClO)2受空气中的CO2、水作用,即产生有漂白、杀菌作用的次氯酸和一种沉淀;
④碳酸钙和盐酸反应生成二氧化碳,所以长期露置于空气中的漂白粉,加稀盐酸后产生的气体是二氧化碳.
解答 解:(1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;Cl2+H2O=HCl+HClO;干燥的有色布条无明显现象,潮湿的有色布条褪色,
故答案为:干燥的有色布条无明显现象,潮湿的有色布条褪色;
(2)为了防止氯气尾气污染空气,可用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH;
(3)①石灰乳吸收工业氯气尾气制得漂白粉生成氯化钙、次氯酸钙,反应的化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O,
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
②漂白粉的有效成分是次Ca(ClO)2,故答案为:Ca(ClO)2;
③次氯酸钙Ca(ClO)2受空气中的CO2、水作用,即产生有漂白、杀菌作用的次氯酸和一种沉淀,反应的化学方程式为:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;
故答案为Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;
④碳酸钙和盐酸反应生成二氧化碳,所以长期露置于空气中的漂白粉,加稀盐酸后产生的气体是二氧化碳,故选C.
点评 本题考查了次氯酸的漂白性、氯气的性质,知道次氯酸漂白性原理,会根据氯气和水反应原理分析氯气和碱溶液反应原理,注意次氯酸是强氧化性弱酸.


科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1mol O2和2mol SO2反应生成的SO3分子数为2NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子数为0.3NA | |
| D. | H2O2分解产生1molO2,转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s c/(mol•L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/(mol•L-1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中溶液变黄,③中溶液橙色加深 | |
| B. | ②中Cr2O72-被C2H5OH氧化 | |
| C. | 对比②和④可知K2Cr2O7酸性溶液氧化性强 | |
| D. | 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.400mol•L-1 | B. | 0.300mol•L-1 | C. | 0.200mol•L-1 | D. | 0.100mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2熔点高,可用作光导纤维 | |
| B. | Li还原性强且质轻,常用作负极材料 | |
| C. | Fe2(SO4)3具有氧化性,能用作净水剂 | |
| D. | SO2能杀菌,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 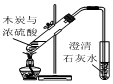 用如图所示装置验证反应产物二氧化碳 | |
| B. | 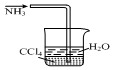 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 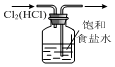 用如图装置除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的pH减小 | |
| C. | 该反应中NO${\;}_{2}^{-}$被还原 | |
| D. | X可以是盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com