
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
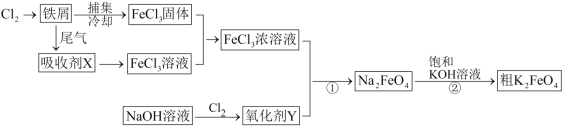
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
【答案】
(1)Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)FeCl2;NaClO
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行
(5)B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率
(6)FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-
【解析】
试题分析:(1)氯化铁水解生成的氢氧化铁胶体具有吸附性,能够吸附杂质可做净水剂,故答案为:Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)根据流程图,吸收剂X吸收氯气后能够生成氯化铁,因此X为氯化亚铁,氢氧化钠与氯气反应生成氧化剂Y,因此氧化剂Y为次氯酸钠,故答案为:FeCl2;NaClO;
(3)碱性条件下,氯化铁与次氯酸钠反应生成高铁酸钠,因此反应①的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)由于K2FeO4溶解度小于NaFeO4,析出晶体,促进2KOH+NaFeO4=K2FeO4+2NaOH反应进行,故答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)由于4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用碱性溶液,故选B;除了氢氧化钠外,一般工业生产还要加入异丙醇作为洗涤剂,是因为高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率,故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)高铁酸钾具有氧化性,在设计的电池中发生还原反应,二氧化硫具有还原性,能够发生氧化反应,生成三氧化硫,因此电池的正极反应式为FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-,故答案为:FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物
B. 酸性氧化物不一定是非金属氧化物
C. 金属氧化物一定是碱性氧化物
D. 纯净物只由一种原子组成,而混合物由多种原子组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A. 用水鉴别乙醇、甲苯和溴苯
B. 用燃烧法鉴别乙醇、苯和四氯化碳
C. 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D. 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式表示正确的是
A. 用惰性电极电解NaCl溶液2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+
C. 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O =2Cr3++6Fe3++14OH-
D. Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中投入一小块金属钠 B.向水中通入二氧化硫气体
C.将水加热煮沸 D.向水中加硫酸钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 合成纤维和人造纤维统称为化学纤维
B. 天然蛋白质水解最终都生成氨基酸
C. 涤纶燃烧时有烧焦羽毛的气味
D. 天然橡胶属于线型高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示:
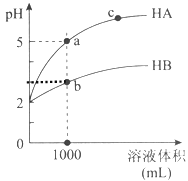
(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)= mol/L。
(2)由图可判断:HA的酸性 (填“>”或“<”)HB的酸性。
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com