
| A、0.1 mol?L-1CH3COOH溶液加水稀释,n(H+)增大 |
| B、0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
| C、向含等浓度的KCl和KI的混合溶液,滴加少量AgNO3溶液生成黄色沉淀,说明同温度下Ksp(AgCl)大于Ksp(AgI) |
| D、若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3) |


科目:高中化学 来源: 题型:
| A、Na+、Fe3+、I-、SCN- |
| B、H+、NH4+、NO3-、CH3COO- |
| C、K+、Ba2+、Cl-、Br- |
| D、Ag+、NO3-、CO32-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O=Ca(OH)2 |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、Cl2+2H2O=HCl+HClO |
| D、2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、20g重水(D2 O)所含的电子数为10NA |
| C、标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
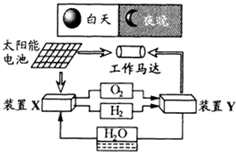 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学电池的反应本质是复分解反应 |
| B、铅蓄电池放电时,是电能转变为化学能的过程 |
| C、锌锰干电池碳棒是负极,锌片是正极 |
| D、锌锰干电池工作一段时间后锌外壳逐渐变薄 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com