
【题目】已知HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓;将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为( )
A.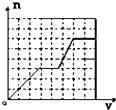
B.
C.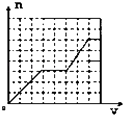
D.
【答案】B
【解析】解:HCO3﹣先与OH﹣反应,再与AlO2﹣反应,而HCO3﹣与OH﹣反应生成CO32﹣后,Ba2+与CO32﹣生成沉淀,
HCO3﹣+OH﹣+Ba2+═BaCO3↓+H2O①,消耗1molHCO3﹣、1molOH﹣、1molBa2+ , 生成1molBaCO3沉淀,此阶段化学方程式为KHCO3+Ba(OH)2═BaCO3↓+H2O+KOH;
HCO3﹣+OH﹣═CO32﹣+H2O②,消耗2mol HCO3﹣、2molOH﹣ (OH﹣消耗完),没有沉淀生成.此阶段化学方程式为KHCO3+KOH═K2CO3+H2O(此时KOH有2mol,原溶液中有1mol,反应①产生1mol);
HCO3﹣+AlO2﹣+H2O═CO32﹣+Al(OH)3↓③,消耗1molHCO3﹣、1mol AlO2﹣(AlO2﹣消耗完),生成1molAl(OH)3沉淀.此阶段化学方程式为KHCO3+KAlO2+H2O═Al(OH)3↓+K2CO3 . 三阶段消耗KHCO3的物质的量为1:2:1,也即KHCO3溶液体积比为1:2:1;一、三阶段对应的生成沉淀的物质的量为1:1,第二阶段不生成沉淀,所以图象B符合,
故选:B.


科目:高中化学 来源: 题型:
【题目】能用铝作原料来冶炼难熔的金属是因为( )
A.铝的密度小,熔点较低
B.铝在空气中燃烧放出大量的热
C.铝在金属活动性顺序表中排在较前面
D.铝具有还原性,发生铝热反应时放出大量热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化铝在陶瓷、电子、生物医药等方面有广泛的用途,它可通过硫酸铝铵晶体热分解得到[已知:硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)424H2O,相对分子质量为906].制备硫酸铝铵晶体的实验流程如下: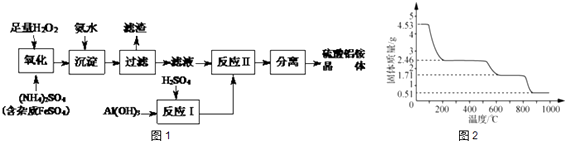
(1)H2O2氧化FeSO4的离子方程式为 .
(2)加入氨水的目的是 , 其化学反应方程式为 .
(3)若要保证产品的纯度,必须检验加入氨水后杂质是否除尽.其实验操作是:用试管取少量滤液, , 则说明杂质已除净.
(4)上述流程中,“分离”所包含的操作依次为:、、过滤、洗涤、干燥;请完成硫酸铝铵晶体高温分解的化学方程式:2Al2(NH4)2(SO4)424H2O═ Al2O3+NH3↑+SO3↑+ .
(5)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图2所示.请计算确定400℃时(硫酸铵未分解)剩余固体成分的化学式为(H:1 N:14O:16 Al:27 S:32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=283.0 kJ·mol1②
CO2(g) ΔH=283.0 kJ·mol1②
C(石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1③
CO2(g) ΔH=393.5 kJ·mol1③
则4Fe(s)+3O2(g)![]() 2Fe2O3(s)的ΔH为
2Fe2O3(s)的ΔH为
A.+1 164.1 kJ·mol1 B.1 641.0 kJ·mol1
C.259.7 kJ·mol1 D.519.4 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰) ![]() Sn(s,白) ΔH3=+2.1kJ·mol-1
Sn(s,白) ΔH3=+2.1kJ·mol-1
下列说法正确的是( )
A. ΔH1>ΔH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com