
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、K+、Cl-、SO32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C. ![]() 的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+) =10-12mol/L的溶液:Na+、K+、CO32-、SO42-
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】氯丹是一种广效性杀虫剂,其结构简式如图所示。下列关于氯丹组成的叙述中,不正确的是
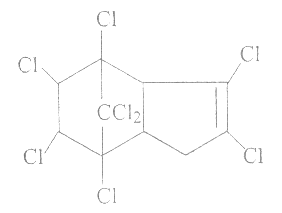
A. 氢、氯、碳的原子个数比是2:4:5
B. 属于卤代烃
C. 分子中含有两种官能团
D. 可以与HCl发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 4.2g C3H6中含有的碳碳双键数一定为0.1NA
B. 1mol苯乙烯中含有的碳碳双键数为4NA
C. 30g乙酸和葡萄糖的混合物中总原子数为4NA
D. 标准状况下,2.24 L乙醇完全燃烧生成的H2O分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A是一种重要的化工原料,其在标准状况下的密度为1.25g/L。
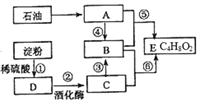
(1)淀粉的分子式为_______; D中的官能团名称为_______。
(2)简述检验反应①有D生成的实验方法:_____。
(3)物质B、C、E可以用 _______(填写试剂名称)鉴别。
(4)反应⑤的化学方程式为________。
(5)写出反应⑥的化学方程式并标注B、C断裂的化学键部位____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业生产的说法中,不正确的是
A. 工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅
B. 氯碱工业中所用的交换膜为阳离子交换膜不让氢氧根通过,防止与氯气反应造成氢氧化钠不纯。
C. 生产普通玻璃的主要原料有石灰石、石英和纯碱
D. 在高炉炼铁的反应中,焦炭为铁矿石的还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种含氮物质相互转化的关系如图所示。其中A、B、C、D常温下都是气体,且B呈红棕色。写出下列各步反应的化学方程式。
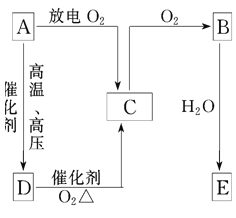
(1)A→C:___________________________
(2)D→C:___________________________
(3)B→E:___________________________
(4)C→B:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为 _____ 。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 ____ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:
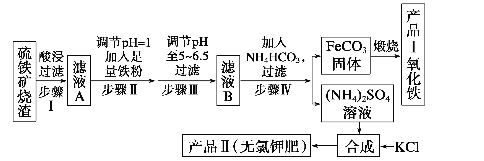
回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ____ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为______ 。
(3)写出步骤Ⅳ反应的离子方程式:______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com