
【题目】水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是( )
A. 氧原子的杂化类型发生了改变 B. 微粒的形状发生了改变
C. 微粒的化学性质发生了改变 D. 微粒中的键角发生了改变
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为K= ![]() 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是( )
A.该反应的化学方程式为:NO2+CO═CO2+NO
B.该反应的焓变为负值
C.升高温度,正反应速率减小
D.恒温时,增大压强,颜色加深,因平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是
A. 它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点
B. 它易导电、导热,具有延展性
C. 它的熔、沸点比Zn的低
D. 它的硬度和强度比Cd的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出。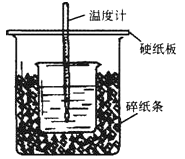
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤
B.①②③④
C.②③④⑤
D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”或“不相等”),所放出的热量(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会(填“偏大”、“偏小”或“无影响”).
(5)(Ⅱ)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6 的分子结构如下图所示,现提供以下化学键的键能: ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 ,
kJ·mol-1 , ![]() :
: ![]() kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
kJ·mol-1 , 则反应P4(白磷) +3O2=P4O6的热化学反应方程式为。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式 。
(7)化学反应N2+3H2 ![]() 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是。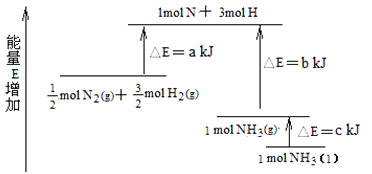
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和镁在元素周期表中有特殊“对角线”关系,它们的性质相似。下列有关锂及其化合物叙述正确的是
A. Li2SO4难溶于水
B. Li与N2反应产物是Li3N
C. LiOH易溶于水
D. LiOH与Li2CO3受热都很难分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的序号填在横线上:
A.萃取法 B.结晶法 C.分液法 D.蒸馏法 E.过滤法
①分离NaCl溶液与沙子的混合物__;
②分离水和汽油的混合物__;
③分离互溶的四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物__;
④从碘的水溶液中提取碘__;
⑤从硫酸钾溶液中得到硫酸钾固体__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用烃A合成高分子化合物N的流程如下图: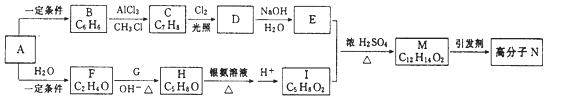
经测定烃A在标准状况下的密度为1.16g·L-1 , F和G是同系物,核磁共振氢谱显示有机物H中有四种峰,且峰值比为3:3:1:1。
已知:Ⅰ. 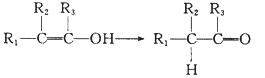
Ⅱ. ![]()
Ⅲ. 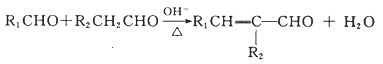 (R1、R2、R3代表烃基或氢原子)。
(R1、R2、R3代表烃基或氢原子)。
回答下列问题:
(1)写出A的结构简式:。
(2)H中所含官能团的名称是。
(3)H→I、M→N的反应类型分别是、。
(4)写出F和G反应生成H的化学方程式。
(5)E和I反应生成M的化学方程式为。
(6)芳香族化合物Q是M的同分异构体,与M具有相同官能团,且水解可以生成2-丙醇,则Q的种类有种。(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com