
| A. | 为控制水浴温度为85~90℃,把温度计插入反应液中 | |
| B. | 为除去阿司匹林中混有的杂质,可在粗产品中加足量NaHCO3溶液、搅拌、过滤、洗涤沉淀,干燥即得精品 | |
| C. | 一定条件下,1mol阿司匹林最多可与2mol的NaOH反应 | |
| D. | 可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸 |
分析 用水杨酸和乙酸酐制备阿司匹林,发生 ,
,
A.该反应不需要控制温度;
B.阿司匹林、乙酸均与碳酸氢钠反应;
C.阿司匹林中-COOC-、-COOH及水解生成的酚-OH均与NaOH反应;
D.只有水杨酸中含酚-OH,与FeCl3溶液发生显色反应.
解答 解:用水杨酸和乙酸酐制备阿司匹林,发生 ,
,
A.该反应不需要控制温度,则不需要水浴加热,故A错误;
B.阿司匹林、乙酸均与碳酸氢钠反应,则加碳酸氢钠不能除杂,故B错误;
C.阿司匹林中-COOC-、-COOH及水解生成的酚-OH均与NaOH反应,则一定条件下,1mol阿司匹林最多可与3mol的NaOH反应,故C错误;
D.只有水杨酸中含酚-OH,与FeCl3溶液发生显色反应,则可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸,故D正确;
故选D.
点评 本题考查化学实验方案的评价及有机物的结构与性质,为高频考点,把握有机制备原理、官能团与性质为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 含有0.5个氧分子 | B. | 摩尔质量是32g/mol | ||
| C. | 含有3.01×1023个氧分子 | D. | 质量是16g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
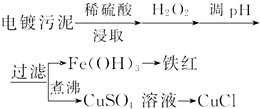
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
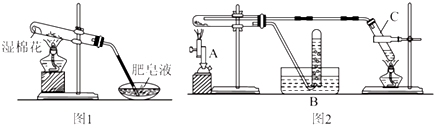
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com