
科目:高中化学 来源:2016-2017学年湖北沙市高一上第一次双周练化学卷(解析版) 题型:实验题
(1)下列关于实验的叙述中正确的有__________。
A.实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
B.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火 |
C.使用分液漏斗前要检查其是否漏水 |
D.用托盘天平称量物质质量时,物品应置于右盘 |
E.可燃性气体点燃前一定要验纯
F.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
(2)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
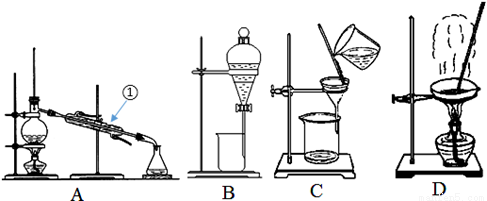
①从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);
分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置__________,该分离方法的名称为______________。
②从碘水中分离出I2,选择装置__________,该分离方法的名称为__________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在 (填“上层”或“下层”)液体中,该层溶液颜色为__________。
③装置A中①的名称是__________,进水的方向是从___________(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A.0.1 mol·L–1 Na2SO4溶液含有的钠离子数目为0.2NA
B.标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA
C.常温常压下,32 g O3含有的氧原子数目为2NA
D.56 g的Fe与足量的稀盐酸完全反应转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017年黑龙江佳木斯一中高一上9.10周练化学卷(解析版) 题型:选择题
下列叙述正确的是( )
A.同温同压下,物质的物质的量相等,其体积一定相同
B.等体积的二氧化碳和一氧化碳所含分子数一定相等
C.1L甲烷气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源:2016-2017年黑龙江佳木斯一中高一上9.10周练化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,22.4L苯含有的分子数为1NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.01NA
C.2.4g金属镁变成镁离子时失去的电子数为0.1NA
D.常温常压下,80gSO2含有的氧原子数为2.5NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:实验题
某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验 编号 | 0.01mol•L﹣1 酸性KMnO4溶液 | 0.1mol•L﹣1 H2C2O4溶液 | 水 | 1mol•L﹣1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
Ⅲ | V3 mL | V4 mL | V5 mL | 0 | 50 | 30 |
Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至 时记时结束;
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则V1= V2= V3= V4= V5= ;
(3)从实验数据分析,实验I和IV研究 对反应的影响;
(4)请配平上面的化学方程式: KMnO4+ H2C2O4+ H2SO4= K2SO4+ MnSO4+ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上9月月考化学卷(解析版) 题型:选择题
在恒温时,一容积不变的密闭容器中发生反应:2NO2(g)  N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数( )
N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比NO2的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上学期9月月考化学试卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期9月月考化学试卷(解析版) 题型:推断题
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 。
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 。(黑色球表示F原子)
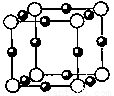
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料。其晶体中所含的化学键类型为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com