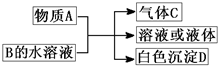
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO
3和H
2O.则B(只含两种元素)的化学式为
CO2
CO2
,其固态时的晶体为
分子
分子
晶体;C分子中含有的化学键类型是
极性键和非极性键
极性键和非极性键
.
(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.
②工业上冶炼A的化学方程式
.
③实验室用惰性电极电解100mL 0.1mol/L A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
13
13
(忽略反应前后溶液的体积变化).某电极附近溶液颜色变红,原因是
氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
,则该电极与外接直流电源的
负
负
极相连接(填“正”、或“负”).
(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
.
(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是
H2SiO3
H2SiO3
.

 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2011?崇文区模拟)一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
(2011?崇文区模拟)一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应: p C(g)+q D(g)达到平衡后,测得B的浓度为0.5
p C(g)+q D(g)达到平衡后,测得B的浓度为0.5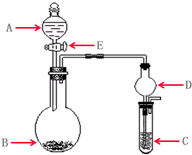 (2011?崇文区模拟)实验室需要少量某些气体时,通常使用快速的方法制备.下列几个实验可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)
(2011?崇文区模拟)实验室需要少量某些气体时,通常使用快速的方法制备.下列几个实验可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)