
分析 (1)①原子具有一定数目质子和一定数目中子为一种原子;
②元素是具有相同核内质子数(或核电荷数)的一类原子的总称;
③根据元素的化合价与价电子之间的关系判断;
(2)${\;}_{1}^{1}H$2${\;}_{8}^{18}O$的摩尔质量为20g/mol,根据n=$\frac{m}{M}$计算2g${\;}_{1}^{1}H$2${\;}_{8}^{18}O$的物质的量;根据质量数=质子数+中子数计算原子含有中子数,进而计算2g该分子含有的中子数目;
(3)阳离子:质量数=质子数+中子数,核外电子数=质子数-所带电荷数,据此分析解答.
解答 解:(1)①原子是具有一定数目质子和一定数目中子的一种原子,原子种类由质子数和中子数决定,
故答案为:AB;
②元素是具有相同核内质子数(或核电荷数)的一类原子的总称,由质子数决定,
故答案为:A;
③化学性质主要由价电子决定,而主族元素价电子一般就是最外层电子,而副族元素大多还包括次外层的一些电子,
故答案为:D;
(2)${\;}_{1}^{1}H$2${\;}_{8}^{18}O$的摩尔质量为20g/mol,2g${\;}_{1}^{1}H$2${\;}_{8}^{18}O$的物质的量n=$\frac{m}{M}$=$\frac{2g}{20g/mol}$=0.1mol,分子含有中子数为[0+(18-8)]=10,故含有的中子数目为0.1mol×10×6.02×1023mol-1=NA 或6.02×1023,
故答案为:0.1mol;NA 或6.02×1023;
(3)对应微粒R2+来说,质量数=质子数+中子数,核外电子数=质子数-所带电荷数,所以该离子的核外电子数=质量数-中子数-所带电荷数=A-N-2,
故答案为:A-N-2.
点评 本题考查原子构成、物质的量有关计算,侧重对基础知识的巩固,注意掌握以物质的量为中心的有关计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁是一种银白色金属 | |
| B. | 铁在常温下与水不反应,但可在高温条件下与水蒸气反应生成Fe3O4和H2 | |
| C. | 常温下,铁与浓HNO3、浓H2SO4均不反应 | |
| D. | 铁在氯气中燃烧生成FeCl3,其溶于水形成的溶液呈棕黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正反应速率增大,逆反应速率减小 | |
| B. | 若正反应是放热反应,则A为气态 | |
| C. | 物质A一定为非气态,且正反应是吸热反应 | |
| D. | 若向容器中充入稀有气体,则平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.03×1022 | B. | 0.15mol | C. | 10.65g | D. | 0.075mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
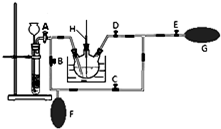 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
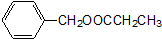 )是其中的一种,它可以从茉莉花中提取,也可以人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以人工合成.一种合成路线如下: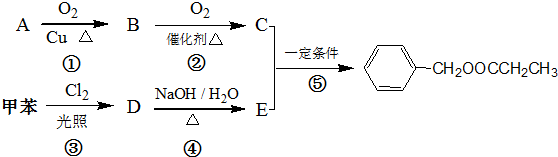
 .
.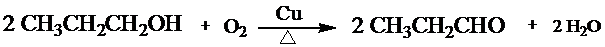 ,④
,④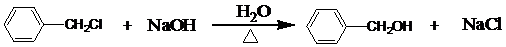
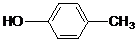
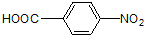 )的流程图;(示例:CH3CH2OH$→_{Cu△}^{O_{2}}$CH3CHO)
)的流程图;(示例:CH3CH2OH$→_{Cu△}^{O_{2}}$CH3CHO)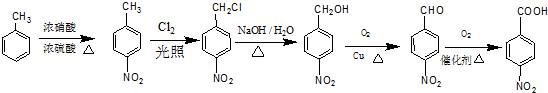 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 、丙
、丙 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com