
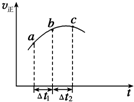
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,由图可得出的正确结论是( )| A. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 反应物浓度:a点小于b点 | |
| D. | 反应在C点达到平衡状态 |
分析 A.△t1=△t2时,vt=n,根据图象知,ab段vt之积大于bc段,则ab段参加反应的物质的量大于bc段;
B.是绝热条件下,当达到平衡状态时,温度升高,正反应速率降低,说明平衡逆向移动,则正反应是放热反应;
C.反应向正反应进行,随着反应的进行,反应物浓度逐渐降低;
D.当正反应速率不变时,达到化学平衡状态.
解答 解:A.△t1=△t2时,vt=n,根据图象知,ab段vt之积大于bc段,则ab段参加反应的物质的量大于bc段,反应初始物质的量相等,所以SO2的转化率:a~b段小于b~c段,故A正确;
B.是绝热条件下,当达到平衡状态时,温度升高,正反应速率降低,说明平衡逆向移动,则正反应是放热反应,所以反应物总能量大于生成物总能量,故B错误;
C.反应向正反应进行,随着反应的进行,反应物浓度逐渐降低,所以反应物浓度a点大于b点,故C错误;
D.当正反应速率不变时,达到化学平衡状态,根据图知,C点是平衡后的点,所以不是平衡点,故D错误;
故选A.
点评 本题考查反应速率和化学平衡知识,意在考查学生读图分析问题的能力,明确各个点的含义及vt之积含义是解本题关键,会判断平衡点,易错选项是C.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
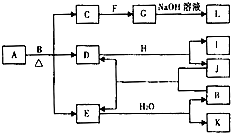 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3 | B. | FeCl2 | C. | Na2SO3 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它们的熔点相近 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的固体是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③⑤ | C. | ②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| B. | 大理石和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液和稀硝酸反应:HCO3-+H+═H2↑+CO32- | |
| D. | 盐酸和氢氧化钾溶液反应:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com