
在一定条件下,对于在密闭容器中进行的反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( )
A. 达到化学平衡时,v正(O2)=v逆(NO)
B. 若单位时间内生成2mol NO的同时消耗2 molNH3
C. NH3、O2、NO、H2O在容器中共存
D. c(NH3)保持不变
考点: 化学平衡状态的判断.
分析: 根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题.
解答: 解:A、v正(O2)=v逆(NO)不符合速率之比等于化学计量数之比,不能说明正逆反应速率相等,不能说明反应达到平衡,故A不符合;
B、无论反应是否达到平衡状态,生成2mol NO的同时都消耗2 molNH3,不能判断是否达到平衡状态,故B不符合;
C、可逆反应各种物质共存,不能说明反应达到平衡,故C不符合;
D、NH3浓度不再变化说明反应达到平衡,故D符合;
故选D.
点评: 本题考查化学平衡状态的判断,题目难度不大,本题注意B项为易错点,反应物和生成物都是气体,质量守恒,容器的体积不变,则密度不变.


科目:高中化学 来源: 题型:

已知某可逆反应mA(g)+nB(g)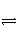
 pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s)===C(金刚石,s) ΔH>0。则金刚石比石墨稳定
B.已知2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol。则H2的燃烧热为285.8 kJ/mol
C.已知2C(s)+O2(g)===2CO(g)
ΔH=-221.0 kJ/mol。则C(碳)的燃烧热为110.5 kJ/mol
D.已知2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol。则该反应的中和热为114.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
密闭容器中发生如下反应:A(g)+3B(g)2C(g) ΔH<0,根据下列速率—时间图象,回答下列问题:
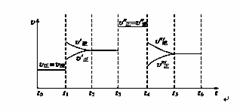
(1)产物C的体积分数最大的时间段是________;
(2)上述图象中C的体积分数相等的时间段是________;
(3)反应速率最大的时间段是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项表达正确的是( )
A. H2O的分子模型示意图: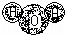
B. F的结构示意图: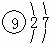
C. 乙烯分子的结构简式:CH2CH2
D. CaCl2的电子式:
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
A. 2H2(g)+O2(g)=2H2O(l);△H=﹣484kJ/mol
B. H2O(g)=H2(g)+ O2(g);△H=﹣242kJ/mol
O2(g);△H=﹣242kJ/mol
C. 2H2(g)+O2(g)=2H2O(g);△H=+484kJ/mol
D. H2(g)+ O2(g)=H2O(g);△H=﹣242kJ/mol
O2(g)=H2O(g);△H=﹣242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
A. Al3+的结构示意图:
B. 水的电子式:
C. 乙烯的结构简式:CH2CH2
D. 含有7个中子的碳原子: C
C
查看答案和解析>>
科目:高中化学 来源: 题型:
近年以来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 活性炭 NO E F
活性炭 NO E F
T1 2.000 0.040 0.030 0.030
T2 2.005 0.050 0.025 0.025
①请结合上表数据,写出NO与活性炭反应的化学方程式 .
②上述反应的平衡常数表达式K= ,根据上述信息判断,T1和T2的关系是 .
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是 .
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示
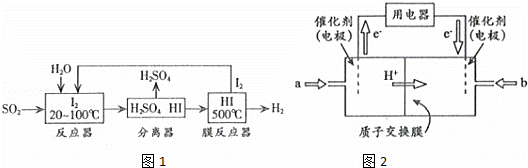
①用离子方程式表示反应器中发生的反应: .
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 .
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的 极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Cl﹣ | |
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | / | Cl2 |
|
| A. | 表中①组反应可能有一种或两种元素被氧化 |
|
| B. | 氧化性强弱比较:KClO3>Cl2>Fe3+>Br2 |
|
| C. | 表中②组反应的离子方程式是2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O |
|
| D. | 表中③组反应的还原产物是KCl,电子转移数目是6e﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com