
(15分)元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):

其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是: 。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ,析出该复盐晶体的原理是 。
(1) 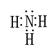 (1分)
(1分)
(2)3NH3·H2O+Al3+=Al(OH)3↓+3NH4+ (2分) Fe+2Fe3+=3Fe2+ (2分)
(3)H2O2分子间存在氢键 (2分)
(4)(NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4 ·FeSO4·6H2O (2分)
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2·6H2O (2分)
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多 (2分)
【解析】A元素原子核内只有一个质子,则A是氢元素。标准状况下的密度为0.759g·L—1,则相对分子质量是0.759×22.4=17,所以是氨气,即B是氮元素。C元素原子的最外层电子数是其内层电子数的3倍,所以C是氧元素。E与C同主族,则E是硫元素。D、F为常见金属元素,且均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应,所以D是铝。均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,则F是铁元素。
(1)氨气含有极性键,电子式为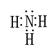 。
。
(2)氨水和铝离子反应生成氢氧化铝沉淀,方程式为3NH3·H2O+Al3+=Al(OH)3↓+3NH4+。含有铁元素的乙与丁分别是铁和铁离子,方程式为Fe+2Fe3+=3Fe2+。
(3)戊和己分别是双氧水和硫化氢,由于双氧水中含有氢键,所以沸点高于硫化氢的。
(4)A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式为(NH4)2Fe(SO4)2。根据反应物和生成物可知,方程式为(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2·6H2O。由于 硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多,所以会形成晶体。


科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.| c(H+)甲 | c(H+)乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com