
(8分)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪 器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
(4)滴定。当____________________ ________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅰ.(1)容量瓶 (2)酚酞 (3)0.70 (4)溶液由无色恰好变为红色,并在半分钟内不褪色
Ⅲ.(1)第1次滴定误差明显大,属异常值,应舍去 0.75 4.5 (2)c (3)ab
解析试题分析:依据中和滴定原理,确定所需仪器、药品、实验步骤,关注每步操作要领及意义。
Ⅰ(1)定容一般要在容量瓶中进行,所以转移到100 mL容量瓶中定容。
(2)强碱与弱酸的滴定,生成的是强碱弱酸盐,显碱性,最好选碱性范围内变色的指示剂,此处指示剂是酚酞。
(3)注意读数从上到下依次递增,此处为0.70mL;
(4)当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定。
Ⅲ. (1)很明显第一组数据比其余三组数据偏大,不能选用,要舍去。
(2)碱式滴定管在滴定时未用标准NaOH溶液润洗,导致标准液浓度偏低,使用时体积偏大,则导致待测液浓度偏大;碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失,会导致测定的标准液体积偏大,待测液的浓度偏大;锥形瓶中加入待测白醋溶液后,再加少量水,并不影响结果;锥形瓶在滴定时剧烈摇动,有少量液体溅出,使用的标准液减少,则待测液浓度偏小。
考点:考查溶液的配制及酸碱中和滴定。
点评:计算平均值时,一定要注意误差较大的数据要舍去。本题难度不大,较综合。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:2012-2013学年山东省德州市跃华学高三12月月考化学试卷(解析版) 题型:实验题
(8分)现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪 器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
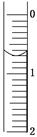
(4)滴定。当____________________ ________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
|
滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
|
V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.实验处理:
(1)某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
指出他的计算的不合理之处:____________ _ _。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com