
【题目】某有机物A30g完全燃烧生成44gCO2和18g水。
(1)若A发生如图反应:
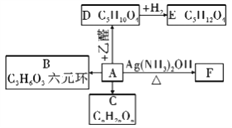
已知:![]() CH3CH=CHCHO
CH3CH=CHCHO
①A中官能团的名称______________;
②请写出物质B的结构简式____________________;
③E可在______________________条件下生成C5H4O4。
(2)若A发如下反应:
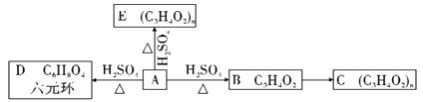
①请写出A生成D的化学反应方程式_______________________________;
②A生成E的反应类型_____________;B生成C的反应类型__________________;
③A的一种同分异构体A1可与A发生类似的反应,不过其生成的D1物质含有八元环。请写出A1的结构简式____________________。
(3)若A发生如下反应:
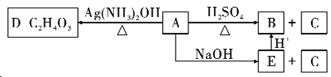
①请写出A的结构简式____________________。
②分子式为C9H18O2的物质M与A属于同一类物质,且可以酸性条件下水解为两种相对质量相同的物质,则符合条件的B的同分异构体有__________种。
【答案】 醛基 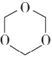 Cu/O2
Cu/O2  +2H2O 缩聚 加聚 HO-CH2-CH2-COOH HCOOCH3 2
+2H2O 缩聚 加聚 HO-CH2-CH2-COOH HCOOCH3 2
【解析】44gCO2和18g水的物质的量分别为![]() =1mol,
=1mol, ![]() =1mol,含有O的物质的量=
=1mol,含有O的物质的量=![]() =1mol,说明该有机物中C、H和O原子的个数比为1:2:1,最简式为CH2O。
=1mol,说明该有机物中C、H和O原子的个数比为1:2:1,最简式为CH2O。
(1) ①根据流程图,A能够与银氨溶液反应,说明A中含有醛基,故答案为:醛基;
②根据A的最简式为CH2O,含有醛基,则A为甲醛(HCHO),A发生醛基的加成反应生成B,B为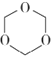 ,故答案为:
,故答案为: ;
;
③根据流程图,结合信息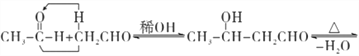 CH3CH=CHCHO可知,乙醛与3分子甲醛反应生成D,D为
CH3CH=CHCHO可知,乙醛与3分子甲醛反应生成D,D为 ,D与氢气加成后生成E,E为
,D与氢气加成后生成E,E为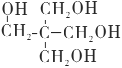 ,E可在Cu/O2条件下发生催化氧化生成C5H4O4(
,E可在Cu/O2条件下发生催化氧化生成C5H4O4(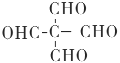 ),故答案为:Cu/O2;
),故答案为:Cu/O2;
(2) A的最简式为CH2O。根据流程图,A在硫酸作用下可以生成B(C3H4O2),B能够生成高分子化合物C[(C3H4O2)n],说明B中含有碳碳双键,说明A脱去了1分子水生成B,因此A中含有羟基;A在硫酸作用下能够反应生成六元环状化合物D(C6H8O4),说明脱去了2分子水,形成了环状酯,因此A为CH3CHOHCOOH。
①A生成D的化学反应方程式为 +2H2O,故答案为:
+2H2O,故答案为: +2H2O;
+2H2O;
②A中含有羟基和羧基,可以发生缩聚反应生成E;B中含有碳碳双键,可以发生加聚反应生成C,故答案为:缩聚;加聚;
③A的一种同分异构体A1可与A发生类似的反应,不过其生成的D1物质含有八元环,则A1的结构简式为,故答案为:HO-CH2-CH2-COOH;
(3) ①A的最简式为CH2O。根据流程图,A能够与银氨溶液反应,说明A中含有醛基,结合D的化学式可知,A含有2个碳原子,A能够与氢氧化钠溶液反应,说明含有酯基,因此A为HCOOCH3,故答案为:HCOOCH3;
②分子式为C9H18O2的物质M与A属于同一类物质,且可以酸性条件下水解为两种相对质量相同的物质,说明M为C3H7COO C5H11;根据流程图,A水解后酸化生成B,说明B为酸,因此符合条件的B为C3H7COOH,由于丙基有2种结构,因此B有2种结构,故答案为:2。


科目:高中化学 来源: 题型:
【题目】在20 ℃时,某气态烃与氧气混合,装入密闭容器中,点燃爆炸后,又恢复到20 ℃,此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎成真空,此烃的分子式可能是( )
A. CH4 B. C2H6 C. C3H8 D. C7H16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | a | 496 |
反应Ⅰ的△H=-98 kJ ·mol-1,则 a=____________。反应Ⅲ的化学方程式为______________。将2molSO2和1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
350 | 5.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是________离子交换膜(填“阴”、“阳”)。

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:

请解释曲线如图变化的原因_______________________________。
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)![]() (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)

(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为_____________。(用含为Ka1、Ka2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。请用化学用语回答下列问题:
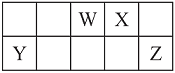
(1)写出W含有8个中子的核素的化学符号_____________。
(2)元素Z的最高价氧化物对应的水化物的化学式为_____________。
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为________________。
(4)X、Z的气态氢化物沸点较高是________,原因是____________________。
(5)化合物Y2X3中含有的化学键类型是________。工业上冶炼Y单质的方法是________(填字母)。
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物F(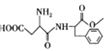 )是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示。
)是一种应用广泛可食用的甜味剂,俗称蛋白糖,它的一种合成路线如图所示。
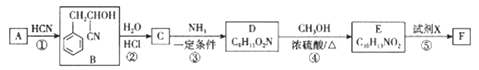
已知:Ⅰ.A能发生银镜反应
Ⅱ. ![]()
请回答下列问题:
(1)D中官能团的名称为_______________,F的分子式为___________________。
(2)A的名称为__________,反应③ 的反应类型为________________。
(3)反应④的化学方程式为_______________________。
(4)反应⑤中的另一种生成物是水,则X的结构简式为__________________。
(5)D有多种芳香族同分异构体,其中符合下列条件的有_________种(不考虑立体异构),
①与D具有相同的官能团 ②苯环上有2 个取代基
其中核磁共振氢谱为6组峰且峰面积比为2:2:2:2:2:1的结构简式为____________(写出一种即可)。
(6)丙烯酸是重要的有机合成原料及合成树脂单体,请写出以CH3CHO为原料合成丙烯酸的合成路线________________________ (其它试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物,我国火电厂粉煤灰的主要氧化物组成为SiO2、A12O3、Fe2O3、CaO、MgO等、利用粉煤灰可制备污水处理的混凝剂(PAFC)及其他化工产品,其下艺流在如下:
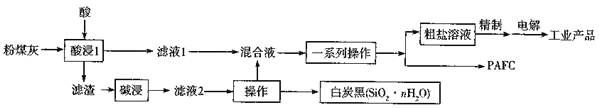
(1)PAFC名称是聚合氧化铝铁,其化学式为[Al2(OH)nCl6-n][Fe2(OH)NCl6-N]M,化学式中n、m、N、M均为整数。已知碱式氯化镁[Mg(OH)2·MgCl2],]可改写为氧化物和氯化物形式2MgO·2HCl,则PAFC改写为氧化物和氯化物形式为__________________。
(2)“酸浸”操作中加入的酸为_______(填字母)
a.稀硫酸 b.浓硫酸 c.稀盐酸 d.稀硝酸
为了提高“酸浸”速率,可采取的措施为___________________。(填两种即可)。
(3)“碱浸"用的是NaOH溶液。该反应的离子方程式为_______________。
(4)“粗盐溶液”“精制”后的“电解”操作中,阴极反应为________________。
(5)常温时,测得流程图中“粗盐溶液”中c(Ca2+)=c(Mg2+)=0.01mol/L,若溶液中阳离子的浓度为1.0×10-5mol/L时可认为该离子除去干净,则Mg2+除干净时的pH=___,此时Ca2+的浓度___。{忽略加入碱液所导致的溶液体积变化;Ksp[Ca(OH)2] =6.0×10-6,Ksp[Mg(OH)2]=2.0×10-11,1g2=0.31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA+bB=dD+eE,若已知40g A可恰好与21g B完全反应生成28g D,则B与E的摩尔质量比为
A.7a:10dB.10a:7dC.10b:7eD.7e:11b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com