
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
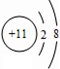 ,I的原子结构示意图
,I的原子结构示意图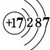 .
. ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
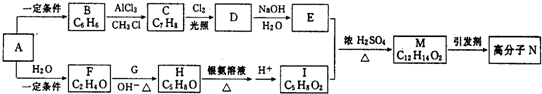
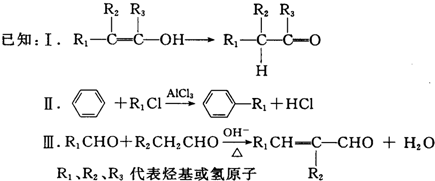
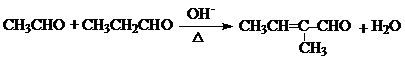 .
.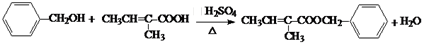 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反应后生成NO的体积为28 L | D. | 所得溶液中溶质只有FeSO4和K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L N2的物质的量为1mol | |
| B. | 标准状况下,1mol任何物质的体积为22.4L | |
| C. | SO2的摩尔质量与相对分子质量相等 | |
| D. | 在相同温度、压强下,相同体积的任何气体分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 蔗糖变黑体现了浓硫酸的脱水性 | |
| B. | 蔗糖体积膨胀变成疏松多孔的海绵状物质炭 | |
| C. | 实验中有大量气体产生体现了浓硫酸的强酸性 | |
| D. | 将产生的气体通入品红溶液,溶液会褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
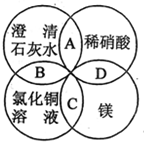 镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
镁、稀硝酸、澄清石灰水、氯化铜溶液是中学化学中的常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A. | OH-+HNO3═H2O+NO3- | B. | Ca(OH)2+Cu2+═Ca2++Cu(OH)2 | ||
| C. | Mg+Cu2+═Cu+Mg2+ | D. | Mg+2H+=Mg2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com