
【题目】铊(81T1)是元素周期表ⅢA族元素,下列关于铊的叙述不正确的是( )
A.铊比铝的金属性更强
B.氢氧化铊一定具有两性
C.铊在化合物中可以是+3价
D.铊能与盐酸反应放出氢气
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
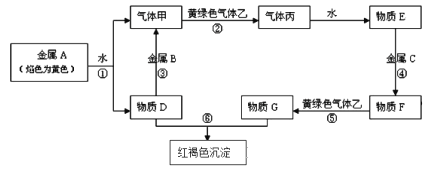
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
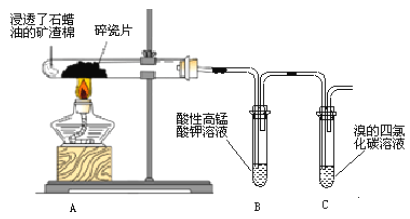
A. 碎瓷片有催化和积蓄热量的作用
B. 结束反应时,先撤出导管,再停止加热
C. 石蜡油是液态烷烃
D. B、C中溶液均褪色,反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应Fe+H2S04=FeS04+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为_____________,该极上发生的电极反应为____________,
II.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)=3C(g)+nD(g),开始时 A为4mol, B为6 mol, 5min末时测得C的物质的量为3mol,用D表示的化学反应速率![]() (D)为 0.2 mol/(Lmin).
(D)为 0.2 mol/(Lmin).
计算:
(1)5 min末A的物质的量浓度为_________。
(2)前5 min 内用B表示的化学反应速率![]() (B))为__________。
(B))为__________。
(3)化学方程式中n的值为_________。
(4)此反应在四种不同情况下的反应速率分别为:

其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,一定量的SO2与1.25molO2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
2SO3(g)△H<0 。30s气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是
A. 达到平衡时,气体的密度是反应前的80%
B. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为209.7g
C. 该温度下的平衡常数为101.25L/moL
D. 0~30s时SO3生成速率为3.0×10-2mol/(L.s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO、NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)NO2可与水发生反应,反应的化学方程式为__________________。若该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为___________。
(3)NH3也是重要的含氮化合物,请写出实验室中由固体物质制取氨气的化学方程式________________________________;工业上可利用NH3经过一系列反应制取硝酸,请写出NH3在催化剂的作用下,与O2反应的化学方程式_________________________________。
(4)硝酸可与不活泼金属铜发生反应。将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),
①写出反应过程其中1个化学反应的化学方程式:_______________________________。
②整个反应过程中,被还原的HNO3总的物质的量是___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com