
下面是人们对于化学科学的各种常见认识,其中错误的是
A.化学面对现代日益严重的环境问题显的无能为力
B.化学将在能源、资源的合理开发和安全应用方面大显身手
C.化学是一门具有极强实用性的科学.
D.化学是一门以实验为基础的自然科学
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.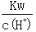 =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
B.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
C.含有NaClO的溶液中:H+、NH4+、SO42-、Br-
D.水电离出的c(H+)=1×10-13mol·L-1的溶液中:NH4+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2016届江西师大附中,九江一中高三上期中化学试卷(解析版) 题型:选择题
下列有关实验操作、现象、解释和结论都正确的是( )
| 操 作 | 现 象 | 解释、结论 |
A | 过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
C | Al箔插入稀硝酸中 | 无现象 | Al在硝酸中钝化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽马鞍山、淮北、铜陵四校高三上第三次联考化学试卷(解析版) 题型:填空题
汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等。对汽车尾气的治理使环境工作者面临了巨大的挑战。试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是____________________;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=______(用含Ka、Kh的代数式表示),此时溶液的温度______25℃(“>”、“<”、“=”)。
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。
CH3OH(g)△H=-90.8KJ•mol-1。不同温度下,CO的平衡转化率如右图所示:图中T1、T2、T3的高低顺序是________,理由是______。

(4)化工上还可以利用CH3OH生成CH3OCH3。在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH | CH3OCH3 | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
该反应的正反应为________反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向_____方向进行(填“正”、“逆”)。
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用。已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如右图所示:
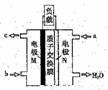
质子穿过交换膜移向_____电极区(填“M”、“N”),负极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川唐徕回民中学高一上10月化学卷(解析版) 题型:选择题
同温同压下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物Z,则化合物Z的化学式可表示为
A.XY3 B.XY C.X3Y D.X2Y3
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:填空题
雾霾天气严重影响人们的生活,氮氧化物和硫氧化物是造成雾霾的主要原因之一。
Ⅰ.将PM2.5样本用蒸馏水处理制成待测试样。
(1)某同学测得该样本所含水溶性无机离子的化学组分及其平均浓度列出下表:(若缺少的离子用H+或OH-补充):
离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
根据表中数据判断该试样的pH=_______;该表有一处笔误,请你指正_____________________。
Ⅱ.消除氮氧化物和硫化物有多种方法。
【方法一 】:工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4(连二亚硫酸钠)和NH4NO3 产品的流程图如图1(Ce为铈元素):
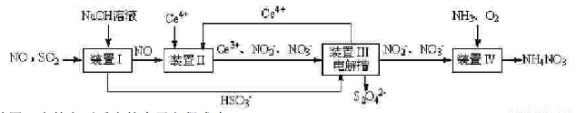
(2)装置Ⅰ中的主要反应的离子方程式为_____________________________。
(3)装置Ⅲ可以使Ce4+中再生,若用甲烷燃烧电池电解该装置中的溶液,当消耗24g甲烷时,理论上可再生______________mol Ce4+。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,
该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7.求吸收液中的SO32-的浓度_____________。(结果保留2位有效数字)
【方法二 】:NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图2所示:
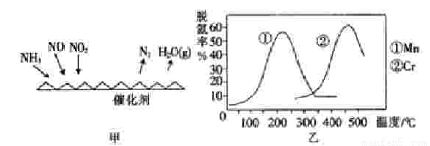
(5)图乙是不同催化剂Mn和Cr在不同温度下对应的脱氢率,由图综合考虑可知最佳的催化剂和相应的温度分别为____________。
(6)用Fe做催化剂时,在氨气足量的情况下,不同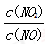 =1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
=1:1脱氢效果最佳.已知生成11.2L N2(标)反应放出的热量为QkJ,此时对应的脱氢反应的热化学方程式为_____________________。
【方法三 】用活性炭还原法可以处理氮氧化物。
反应原理:1/2C(s)+NO(g) 1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
1/2N2(g)+1/2CO2(g) △H=-QkJ/mol
在T1℃时,反应进行到不同的时间测得各物质的浓度如下:
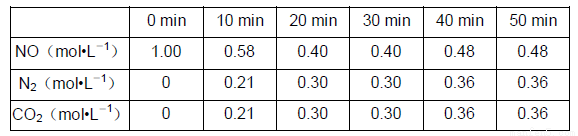
(7)T1℃时,该反应的平衡常数K=_________________________。
(8)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______。
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第三次月考化学试卷(解析版) 题型:推断题
现有原子序数依次增大的W、T、X、Y、Z、R六种前四周期元素.TW3能使湿润的红色石蕊试纸变蓝色.X、Y位于同一主族且Y的原子序数是X的2倍.Z、R是生活中常见金属,Z、R的器皿在潮湿空气中分别生成红褐色锈和绿色锈.
请回答下列问题:
(1)TW3的电子式为 .
(2)由W、T、X、Y中的元索组成一种离子化合物M,能发生如图转化关系:
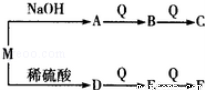
F与E的相对分子质量之差为16.则M的化学式可能为 .
C与水反应的化学方程式为 .
(3)(TW4)2Y2X8能和ZYX4在水溶液中反应生成Z2+和YX42﹣,写出离子方程式 .
(4)常温下,在WTX3浓溶液中以Z、R为电板构成原电池,负极材料是 ,
正极反应式为 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2 → H2O IO3- → I2 MnO4- → Mn2+ HNO3 → NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
A. H2O2 B. IO3- C. MnO4- D. HNO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中理化学卷(解析版) 题型:选择题
在密闭容器中发生如下反应:aX(g)+bY(g)  cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a+b<c+d
C.Z的体积分数增加 D.X的转化率下降
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com