
【题目】下列反应属于吸热反应的是( )。
A.葡萄糖在人体内氧化分解
B.氢气在氧气中燃烧
C.碳酸钙高温分解成氧化钙和二氧化碳
D.氢氧化钾和硫酸中和
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
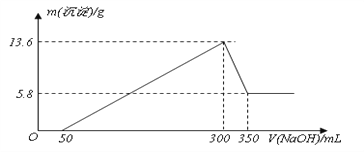
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳的化合物之间很容易发生转化。请回答下列问题:
(1)有机物 M 在有光的时候很容易转化成 N,其过程如下:

M 到 N 过程中,光能转化为 能;其中较稳定的物质是 (用 M、N 回答)。
(1)已知(l)的燃烧热为3267.5kJ·mol-1,
(2)(l)+6O2(g)═6CO2(g)+3H2(g)△H=akJ·mol-1,
则 a -3267.5(填“>”、“<”或“=”)。
(3)在标准状态即压力为 100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化 合物时的反应热称为该化合物的标准摩尔生成焓(△H¢)。已知 100kPa,一定温度下:
Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ·mol-1
C(石墨)+O 2 ( g)=CO2 (g) △H=-390.5kJ·mol
则 Fe2O3 的标准摩尔生成焓△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
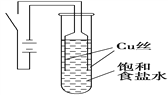
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④CuCl2 , 不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
A.④①②③
B.①③④②
C.④③②①
D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
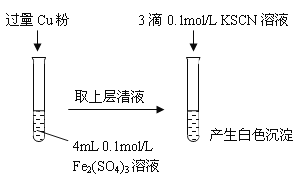
(1)Fe3+与Cu粉发生反应的离子方程式为______________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_______mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ. SCN-的化学性质与I-相似 ⅱ. 2Cu2+ + 4 I-= 2CuI↓+ I2
Cu2+与SCN-反应的离子方程式为_____________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2+ + NO ![]() Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
(3)用离子方程式解释NO 产生的原因_________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是__________________________________________________________________________。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分散系最不稳定的是( )
A.向NaOH溶液中通入CO2得到的无色溶液
B.向碘水溶液中滴加四氯化碳充分振荡后,静置后的下层液体
C.向沸水中滴入饱和的FeCl3溶液得到的红褐色液体
D.向CuSO4溶液中加入NaOH溶液得到的分散系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com