
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是
A.O2是还原产物,Mn2+是氧化产物
B.Na2O2既是氧化剂,又是还原剂
C.标准状况下,产生22.4 L O2时反应转移2 mol e-
D.通常用浓盐酸酸化高锰酸钾溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山西省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作错误的是
A.用胶头滴管加液体时,一般不能伸入试管中
B.蒸馏盛在烧瓶中含有水的酒精,需在瓶内放一些碎瓷片
C.温度计插入液体测量温度的同时,又用它搅拌液体
D.用容积100mL的量筒量取80mL无水乙醇,使液面最低点至刻度80mL处
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省普宁市高一上学期第一次月考化学试卷(解析版) 题型:选择题
某同学在实验室里过滤一种浑浊溶液,发现滤出的液体仍浑浊.他检查实验装置发现漏斗外壁没有水,滤纸也未出现破损或小漏洞,则造成实验失败原因可能是下列操作中的
A.滤纸高出漏斗边缘的部分未剪掉
B.滤纸与漏斗之间有气泡未被排掉
C.倾倒液体时液面高于滤纸边缘
D.过滤时玻璃棒靠在一层滤纸一边
查看答案和解析>>
科目:高中化学 来源:2016届江苏省宿迁市三校高三9月学情调研化学试卷(解析版) 题型:填空题
(12 分)X、Y、Z、W、Q五种元素其核电荷数依次增大。X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子。
(1)Q2+离子的核外电子排布式为 。
(2)XYZ分子中Y原子轨道的杂化类型为 ,1molXYZ分子中含有σ键的数目为 。
(3)写出YZW-离子的两种等电子体的化学式: 。
(4)QW的熔点比Q的硫化物的熔点高,其原因是 。
(5)Q晶体属于六方堆积,其晶胞结构见图14,则P点原子被 个晶胞所共用。
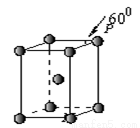
查看答案和解析>>
科目:高中化学 来源:2016届江苏省宿迁市三校高三9月学情调研化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.工业电解饱和食盐水:2Cl-+ H2O = Cl2↑+ H2↑+ OH-
B.碳酸钠的水【解析】
CO32-+ 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
C.硫酸铝溶液中滴加过量浓氨水:Al3++4 NH3·H2O===AlO2-+4NH4++2H2O
D.用过氧化氢从酸化海带灰浸出液中提取碘:2I-+ H2O2 +2H+ = I2 +2H2O
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次月考化学试卷(解析版) 题型:填空题
(6分) 酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数__________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_______mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次月考化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是
① 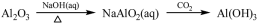
② 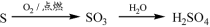
③ 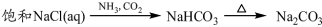
④ 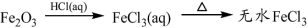
⑤ 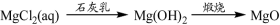
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2016届河南省濮阳市心高三上第一次市统摸底化学试卷(解析版) 题型:选择题
下列关于普伐他汀的水解产物(结构简式如下图)的说法正确的是
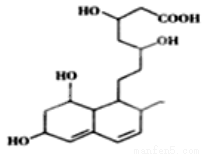
A.含有两种官能团
B.能发生加成、酯化、氧化反应
C.1mol该物质与足量Na反应,产生2.5gH2
D.能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷(解析版) 题型:填空题
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) 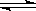 CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是________。
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com