
| A. | H2S | B. | H2SO4 | C. | HClO | D. | HNO3 |
分析 pH相等的强酸溶液,元数越大其浓度越小;元数相同的酸溶液,酸性越弱,pH相同时其浓度越大,据此分析解答.
解答 解:pH相等的强酸溶液,元数越大其浓度越小;元数相同的酸溶液,酸性越弱,pH相同时其浓度越大,硫酸是二元强酸、氢硫酸是二元弱酸,pH相等时硫酸浓度小于氢硫酸;次氯酸是一元弱酸、硝酸是一元强酸,pH相等的次氯酸和硝酸,次氯酸浓度大于硝酸;
硝酸和硫酸都是强酸,pH相等时硫酸浓度小于硝酸,所以pH相等时,物质的量浓度最小的是硫酸,
故选B.
点评 本题考查了电解质的电离及物质浓度与溶液pH的关系,明确决定溶液pH大小的因素是解本题关键,采用对比的方法分析解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| B. | 烧杯b中发生的电极反应为Zn-2e-═Zn2+ | |
| C. | 烧杯a中发生反应O2+4H++4e-═2H2O,溶液pH降低 | |
| D. | 向烧杯a中加入少量KSCN溶液,则溶液会变成红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{NaOH溶液}{→}$NaNO3 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3$\stackrel{NaOH溶液}{→}$NaSiO3 | |
| D. | NaSO4溶液$\stackrel{BaCl_{2}溶液}{→}$BaSO4$\stackrel{盐酸}{→}$BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水 | B. | 0.5mol/L的盐酸 | ||
| C. | 0.5mol/L的醋酸 | D. | 0.5mol/L的氯化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠显示了强还原性 | B. | 二氧化碳是酸性氧化物 | ||
| C. | 金属钠熔点较低 | D. | 二氧化碳也能起助燃作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
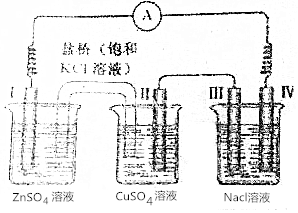
| A. | 电子由电极Ⅳ通过外电路流向电极Ⅰ | |
| B. | 装置工作过程中Ⅲ电极周围出现红色 | |
| C. | 电极Ⅱ发生还原反应 | |
| D. | 盐桥中Cl-向乙池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
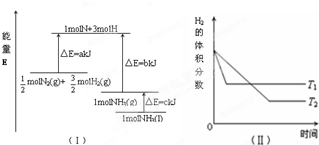
| A. | 该反应的热化学方程式:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | 该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1 | |
| C. | T1>T2,且正反应为放热反应 | |
| D. | 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停业加热 | |
| B. | 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气 | |
| C. | 实验室制备CO气体必须在通风橱中进行 | |
| D. | 蒸馏操作时应在混合液中加入沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO) | |
| B. | 常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol•L-1 | |
| C. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com