(2010?海南)Ⅰ固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染.下列物质中可用做固硫剂的有
A、B
A、B
A.CaO B.Na
2C0
3 C.NH
4N0
3 D.P
20
5Ⅱ以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
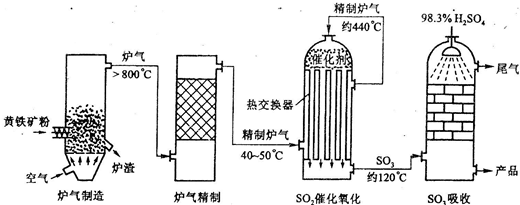
请回答下列问题:
(1)在炉气制造中,生成S0
2的化学方程式为
;
(2)炉气精制的作用是将含S0
2的炉气
除尘、
除尘、
、
水洗
水洗
及干燥,如果炉气不经过精制,对S0
2催化氧化的影响是
砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响
砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响
.
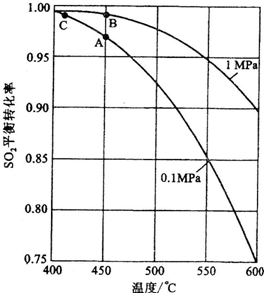
(3)精制炉气(含SO
2体积分数为7%、O
2为ll%、N
2为82%)中S0
2平衡转化率与温度及压强关系如下图所示.在实际生产中,S0
2催化氧化反应的条件选择常压、450℃;左右(对应图中A点),而没有选择S0
2转化率更高的B或C点对应的反应条件,其原因分别是
不选B点,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,所以采用1个大气压
不选B点,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,所以采用1个大气压
、
不选C点,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高,故选择A点,而不选择C点.
不选C点,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高,故选择A点,而不选择C点.
;
(4)在S0
2催化氧化设备中设置热交换器的目的是
利用反应放出的热量预热原料气体
利用反应放出的热量预热原料气体
、
上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全
上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全
,从而充分利用能源.



 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案

