

 N2(g)+3H2(g),
N2(g)+3H2(g),| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

 SO3(g)+NO(g) ΔH=-41.8KJ/mol; (2)40%;
SO3(g)+NO(g) ΔH=-41.8KJ/mol; (2)40%; 2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)
2SO3(g)ΔH="-196.6KJ/mol;" ②2NO(g)+ O2(g)  2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)
2NO2(g) ΔH="-113.0KJ/mol;" ①-②整理可得NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g)
SO3(g)+NO(g) ΔH =-41.8KJ/mol;(2)由于反应是在体积固定的容器中进行,所以反应前后的压强比等于气体的物质的量的比。2NH3(g) N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3) ①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA-
N2(g)+3H2(g)假设有2xmol的氨气反应,则产生N2=xmol;产生H2=3xmol。还有未反应的氨气的物质的量为(1-2x)mol.n(前):n(后)=1:((1-2x)+x+3x)=1:(1+2x)=5:7.解得x=0.2.所以氨气的转化率为(2×0.2)÷1×100%=40%;(3) ①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,发生反应:HA-+OH-=H2O+A2-,所以c(A2-)/c(HA-)的值增大;当不断加入NaOH溶液时,c(H+)减小,c(OH-) 增大,所以c(H+)/c(OH-) 的值减小。②根据物料守恒可得c(Na+)= c(HA-)+ c(H2A)+ c(A2-);根据电荷守恒可得:c(Na+)+ c(H+)+ c(NH4+)= c(OH-)+ 2c(A2-)+ c(HA-)。又因为溶液显中性,所以c(H+)= c(OH-)。将三个式子整理可得c(H2A)+c(NH4+)=c(A2-)。③HA- H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-).
H++A2-。由图像可知。当达到电离平衡时c(HA-)=c(A2-).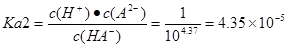 。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。
。④由于H2A过量,结合两种酸的电离平衡常数可知过量的H2A加入到Na2CO3溶液中反应的离子方程式为:2H2A+CO32-=2HA-+CO2↑+H2O。

 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源:不详 题型:单选题
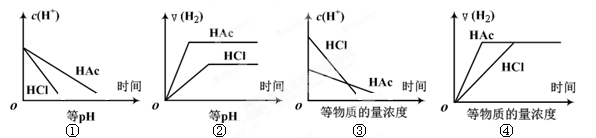
| A.①②③ | B.②④ | C. ①③ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图 |
| B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图 |
| C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
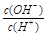 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.上述三种溶液中:c( OH-)大小:③ > ② > ① |
| B.物质酸性的比较:CH3COOH > HF > H2CO3 |
| C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- ) |
| D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度 /(mol·L-1) | 2 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(HF)>c(OH-) | D.c(HF)>c(F-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com