
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届重庆市高三上学期9月月考理综化学试卷(解析版) 题型:选择题
下列实验现象所对应的离子方程式不正确的是
选项 | 实 验 | 现 象 | 离子方程式 |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2===2Fe3++2Cl-、 Fe3++3SCN-===Fe(SCN)3 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH-===Cl-+ClO-+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高一上学期期中测试化学试卷(解析版) 题型:选择题
下列气体有颜色且具有刺激性气味的是
A.O2 B.Cl2 C.NH3 D.N2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中测试化学试卷(解析版) 题型:填空题
工业制硫酸生产流程如下图:

催化室的反应为:2SO2+O2 2SO3 △H<0
2SO3 △H<0
(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 。(填写编号)
a.减少压强 b.升高温度 c.不断补充空气 d.及时分离出SO3
(3)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 。(填写编号)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
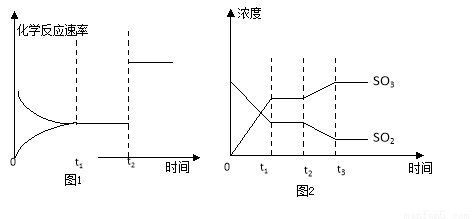
(4)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 。
② 图2中时刻t2发生改变的条件是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述正确是
A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.分别与等物质的量的HCl和CH3COOH反应时,消耗NaOH的物质的量相同
D.由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B+ + OH-
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期第一次月考化学试卷(解析版) 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)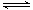 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置A制取氨气,你所选择的试剂是。

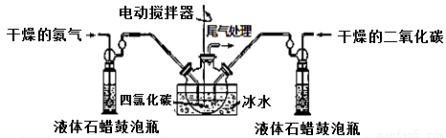
装置A 装置B
(2)制备氨基甲酸铵的装置B如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。

双通玻璃管的作用:;浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为 _____ 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Cl﹣,Na+,H2PO4﹣,PO43﹣,SO42﹣
②含有HCO3﹣的溶液中:SO42﹣,Na+,NO3﹣,MnO4﹣,CO32﹣
③水电离的H+浓度为1×10﹣13mol•L﹣1的溶液中:Cl﹣,HCO3﹣,NO3﹣,NH4+,S2O32﹣
④加入Al能放出H2的溶液中:Mg2+,NH4+,C1﹣,K+,SO42﹣
⑤使甲基橙变红的溶液中:Fe3+,MnO4﹣,NO3﹣,Na+,SO42﹣
⑥在AlCl3溶液中:Fe3+,NO3﹣、I﹣,Cl﹣,SO42﹣
A.①②⑤ B.①③⑥
C.②④⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期期中测试化学试卷(解析版) 题型:填空题
甲醇的研究成为当代社会的热点.
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP 时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为__________.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+ O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2=__________.
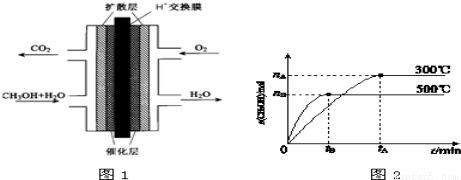
(3)甲醇燃料电池的结构示意图如图1.负极发生的电极反应为____________________.
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
(1)根据图2,纵坐标为CH3OH的物质的量,升高温度,K值将__________(填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是__________(填字母).
a.CO、H2、CH3OH的浓度均不再变化
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.v生成(CH3OH)=v消耗(CO)
e.混合气中n(CO):n(H2):n(CH3OH)=1:2:1
(4)300℃时,将容器的容积压缩到原来的 ,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时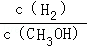 减小.
减小.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期期中测试化学试卷(解析版) 题型:选择题
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、CO32-
B.Mg2+、Cl-、NH4+、SO42-
C.K+、Cl-、HCO3-、NO3-
D.Ca2+、Na+、Fe3+、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com