
【题目】在相同的温度和压强下,氮气和一氧化碳两种气体的分子数相同,则下列它们的( )一定相同。
(1)体积 (2)所含原子个数 (3)物质的量 (4)质量 (5)密度
A. (1)(2)(3)(4)(5) B. 只有(1)(2)(3)
C. 只有(1)(3)(5) D. 只有(2)(3)(4)
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型: ![]()
B.羟基的电子式: ![]()
C.乙醛的结构式:CH3CHO
D.(CH3)3COH的名称:2,2二甲基乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
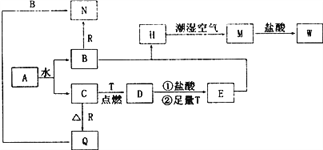
(1)写出下列物质的化学式A____________;D__________;N______________。
(2)按要求写下列反应方程式:H在潮湿空气中变成M的化学方程式______________。D与盐酸反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,属于氧化反应的是 ( )
A. CO32-→CO2 B. Zn→Zn2+ C. MnO2→Mn2+ D. FeCl3→FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18中元素具有重要的用途,在现代工业中备受青睐.
(1)铬是一种硬二脆,抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,电子占据最高能层的符号为 , 该能层上具有的原子轨道数为 , 电子数为 ,
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?(填“是”或“否”),原因是(如果前一问填“是”,此问可以不答)
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为; 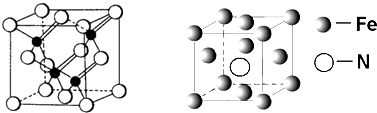
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型;一定压强下将AsH3和NH3 . PH3的混合气体降温是首先液化的是 , 理由是;
(5)铁的多种化合物均为磁性材料,氮化铁石期中一种,某氮化铁的井胞结构如图所示,则氮化铁的化学式为;设晶胞边长为acm,阿伏加德罗常数为NA , 该晶体的密度为g.cm﹣3(用含a和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
(1)Ⅰ.脱硝: 已知:H2的燃烧热为285.8kJmol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJmol﹣1
H2O(g)═H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为: .
(2)Ⅱ.脱碳: 向2L密闭容器中加入2molCO2和6molH2 , 在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)CH3OH(l)+H2O(l)
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 . (填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
③CO2的浓度随时间(0~t2)变化如图1所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化.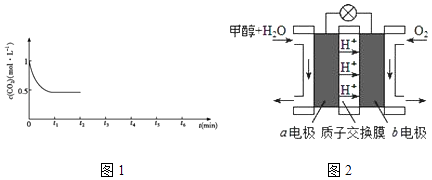
(3)改变温度,使反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度、体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I)c(II).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)= . 在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1T2(填“>”、“<”或“=”).若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡移动(填“正向”“逆向”或“不”).
(4)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O═2HCOOH+O2 , 装置如图所示: ①电极2的电极反应式是;
②在标准状况下,当电极2室有11.2L CO2反应. 理论上电极1室液体质量(填“增加”或“减少”g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应既属于氧化还原反应,且水做氧化剂的是( )
A. 2F2+2H2O=4HF+O2 B. 2Na+2H2O=2NaOH+H2↑
C. CaO+H2O=Ca(OH)2 D. H2+CuO = Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com