
(12分)Ⅰ.甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下: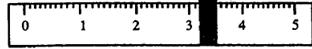
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
科目:高中化学 来源:2014届湖南省名校高三第一次大联考化学试卷(解析版) 题型:选择题
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
|
砝码质量 |
50 |
20 |
20 |
10 |
5 |
|
取用砝码情况 |
先↓后↑ |
↓ |
先↓后↑ |
↓ |
先↓后↑ |
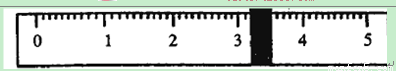
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响
(用偏大、偏小、无影响填写)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
(12分)Ⅰ.甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
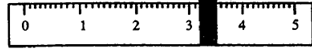
|
砝码质量 |
50 |
20 |
20 |
10 |
5 |
|
取用砝码情况 |
先↓后↑ |
↓ |
先↓后↑ |
↓ |
先↓后↑ |
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ.乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移 ⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是
(从下列中选用 A.10ml B.25ml C.50ml D.100ml)[来源:Zxxk.Com]
(2)第③步实验的操作是
(3)第⑥步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)Ⅰ.甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ.乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移 ⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是
(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)第③步实验的操作是
(3)第⑥步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com