
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)升高温度、增大压强等可以加快反应速率,同时提高转化率,应是平衡正向移动;
(3)a.容器内气体只有钠蒸汽、二氧化碳,若起始时二者物质的量之比为4:3,且二者按4:3反应,气体的平均式量为定值;
b.容器内固体质量不再变化,说明金刚石的质量不变;
c.气体的质量减小,若容器容积不变,气体的密度不断减小;
d.气体的物质的量减小,若容器容积不变,容器内的压强不断减小;
(4)固体质量增加56克,则金刚石的质量为56g,根据方程式计算参加反二氧化碳物质的量,再根据v=$\frac{△c}{△t}$计算v(CO2);
(5)若温度由890℃升高到1860℃,碳酸钠分解生成二氧化碳,混合气体中二氧化碳的含量增大,容器内气体的平均相对分子质量增大;
(6)将产物冷却后,用水溶解,过滤除去碳酸钠,再洗涤干燥可得纯净的金刚石;
(7)石墨转化为金刚石为吸热反应,升高温度有利于石墨转化为金刚石;
石墨中每个C原子与周围碳原子形成3个C-C键,而金刚石中每个C原子与周围的4个C原子形成4个C-C键.
解答 解:(1)若反应在常压、890℃下进行,钠为气体,4Na+3CO2?2Na2CO3+C(s,金刚石)的平衡常数表达式K=$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$,
故答案为:$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$;
(2)正反应为气体体积减小的反应,增大压强可以加快反应速率,且平衡正向移动,同时提高转化率,
故答案为:增大压强;
(3)a.容器内气体只有钠蒸汽、二氧化碳,若起始时二者物质的量之比为4:3,且二者按4:3反应,气体的平均式量为定值,故a错误;
b.容器内固体质量不再变化,说明金刚石的质量不变,反应到达平衡,故b正确;
c.气体的质量减小,若容器容积不变,气体的密度不断减小,故c错误;
d.气体的物质的量减小,若容器容积不变,容器内的压强不断减小,故d错误,
故选:b;
(4)固体质量增加56克,则金刚石的质量为56g,其物质的量为$\frac{56g}{12g/mol}$=$\frac{14}{3}$mol,由方程式可知参加反二氧化碳物质的量为$\frac{14}{3}$mol×3=14mol,故v(CO2)=$\frac{\frac{14mol}{10L}}{4h}$=0.35 mol/(L•h),
故答案为:0.35;
(5)若温度由890℃升高到1860℃,碳酸钠分解生成二氧化碳,混合气体中二氧化碳的含量增大,容器内气体的平均相对分子质量增大,
故答案为:增大;
(6)冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石,
故答案为:冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石;
(7)石墨转化为金刚石为吸热反应,升高温度有利于石墨转化为金刚石,金刚石的含量将增大;
石墨中每个C原子与周围碳原子形成3个C-C键,而金刚石中每个C原子与周围的4个C原子形成4个C-C键,等物质的量的石墨和金刚石中,金刚石含有的化学键的数目较多,
故答案为:增大;金刚石.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、物质的提纯、晶体结构等,是对学生综合能力的考查,难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
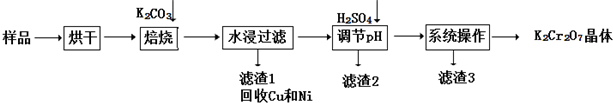
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 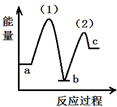 | B. | 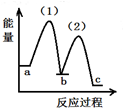 | C. | 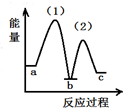 | D. | 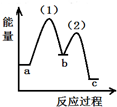 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
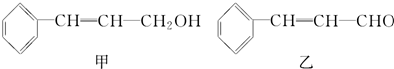
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
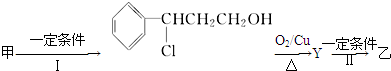
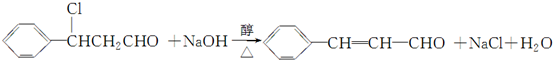 (注明反应条件).
(注明反应条件).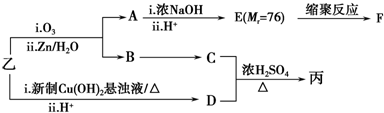
 .
.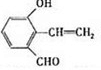 .
.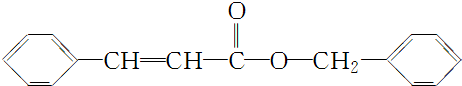 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com