
分析 (1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;(1)n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,氮氧化物的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据得失电子守恒计算二者的物质的量,再根据M=$\frac{m}{n}$计算其平均摩尔质量;
(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,结合(1)根据得失电子守恒分析,或者硝酸钠中的氮是+5价,所以铜失电子全部给铜来求解.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,令NO和NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=1.02}\end{array}\right.$,
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
答:NO的体积为5.824L,NO2的体积为5.376L;
(2)将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度=$\frac{0.5mol+0.001aVmol}{0.14L}$=$\frac{50+0.1aV}{14}$mol/L,
答:原硝酸溶液的浓度$\frac{50+0.1aV}{14}$mol/L;
(3)设需要30%的双氧水mg,根据电子得失守恒,有:0.26×3+0.24×1=0.51×2=30%×$\frac{m}{34}$×2,解得:m=57.8,答:需要30%的双氧水57.8克.
点评 本题以硝酸为载体考查了氧化还原反应的计算,根据氧化还原反应中得失电子进行解答即可,注意守恒思想的运用,注意(2)中不能根据铜计算消耗硝酸的物质的量,铜和硝酸反应时,硝酸可能有剩余,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从NaX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
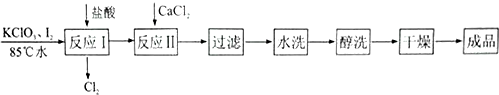
| A. | “反应I”中主要反应的离子方程式为CIO3-+5CL-+6H+=3CL2↑+3H20 | |
| B. | “反应I”适宜在水浴加热的条件下进行 | |
| C. | 进行“反应Ⅱ”之前需向溶液中滴加过量K2C03溶液除去其中的盐酸 | |
| D. | “醇洗”的目的是为了除去产品中某些不溶性杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
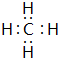 ;
;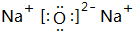 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L、M的单质在相同条件下与相同浓度稀盐酸反应的反应速率为L>M | |
| B. | M与T形成的化合物有两性 | |
| C. | Q是硫元素 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | 原子半径由小到大的顺序为Y<X<W<Z | |
| B. | Y的单质和Z的单质能够发生反应 | |
| C. | X的单质都是熔点高、硬度大的物质 | |
| D. | 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com