
����Ŀ��Ī���εĻ�ѧʽΪ( NH4)2Fe(SO4)2��6H2O������ˮ���������Ҵ�����������������ԭ�ζ��Ļ����������ȡĪ���εIJ���װ����ʵ�鲽�裺

�ٽ���м����С�ձ��У���������Na2CO3��Һ��С����ȼ����ӣ�������Һ��������ˮϴ����м�����ɡ�
������ƿ�м���2.24 g ��м������̼�ۣ��ɷ�Һ©���μ�20 mL 3 mol/L������Һ��
�۴���Ӧ�������ɷ�Һ©������������(NH4)2SO4��Һ�����ˡ�����Һ�м���һ�������Ҵ����������������ˡ�ϴ�ӡ����ɣ���Ī���ξ��塣
��ش��������⣺
��1��ʵ�鿪ʼǰ����鷴Ӧ�������Եķ���Ϊ_____________________��
��2���������Na2CO3��Һ��������_____________________________________��
��3��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���е�ԭ����__________________����������̼�۵�������_________________________________________��
��4��������������������2 mol/L ��(NH4)2SO4��Һ______________mL��
��5��ȡ10.00 g����ͭ��Ʒ�������еĸ�����ΪH2CrO4���ټ��������ữ�������250mL��Һ��ȡ��25.00 mL��Ũ��Ϊ0.0180 mol/L��(NH4)2Fe(SO4)2����Һ�ζ����յ�ʱ��ȥ��Һ20.75 mL����֪����H2CrO4����ԭΪCr3+����ζ�ʱ��Ӧ�����ӷ���ʽΪ_____________________________________������Ʒ�и�Ԫ�ص���������Ϊ______��
���𰸡� �ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������á����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������á��� ��ȥ��м��������� ��Һ�����ã�����ֹFe2+�������� ������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���� 20 H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O 0.65��65%
����������1��ʵ�鿪ʼǰ����鷴Ӧ�������Եķ���Ϊ���ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������ã����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������ã�����ȷ�𰸣��ر�ֹˮ�У���Һ©����������ƿ�еμ�ˮ����һ��ʱ���ˮ���ܵ���������Ӧ�����������á����رշ�Һ©����������ֹˮ�У������ܿ�����ˮ����Һ���£�����ƿ�������ܿ������ݲ�����ֹͣ����һ��ʱ��ܿڵ����γ�һ��ˮ������Ӧ�����������ã���
��2��Na2CO3��Һˮ���Լ��ԣ��ܹ������۷�����Ӧ������ϴ�������е����ۣ���ȷ�𰸣���ȥ��м��������ۡ�
��3��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���У��ܹ���Һ�����ã���ֹ������Fe2+����������̼��ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���ʣ���ȷ�𰸣���Һ�����ã�����ֹFe2+����������������ϡ���ṹ��ԭ��أ��ӿ췴Ӧ���ʡ�
��4��2.24 g ��м��20 mL 3 mol/L������Һ��Ӧ���������������������Ϊ0.04mol������������������Ϊ0.04 mol��Ȼ�����(NH4)2SO4+FeSO4+6H2O =( NH4)2Fe(SO4)2��6H2O��Ӧ��֪����n(NH4)2SO4)=0.04 mol, ����c��V=n��֪��0.04=2��V��V=0.02L=20 mL����ȷ�𰸣�20��
��5�����������Ϣ��֪��H2CrO4�ܹ���(NH4)2Fe(SO4)2�е�������������Ϊ�����ӣ�������ԭΪCr3+����Ӧ�����ӷ���ʽΪH2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O�� ���ݷ�Ӧ��ϵ��H2CrO4-3Fe2+��֪��25.00 mL��Һ��n((NH4)2Fe(SO4)2)=n(Fe2+)=0.018��20.75��10-3=3.735��10-4mol, n( H2CrO4)=1.245��10-4mol,��250mL��Һ����n( H2CrO4)=1.245��10-3 mol��m(Cr)= 1.245��10-3��52g; ����Ʒ�и�Ԫ�ص���������Ϊ1.245��10-3��52/10��100%=65%����ȷ�𰸣�H2CrO4+3Fe2++6H+=Cr3++3Fe3++4H2O��65%��0.65


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����л�����������M��lҵ����������Ҫ�����ã���ϳ�·�����£�

��֪����A�����ĺ����������Է�������Ϊ58��̼�������������֮��Ϊ44.8%���˴Ź���������ʾΪһ��壬�ɷ���������Ӧ��
��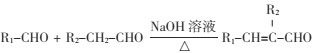
��![]()
��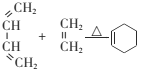
�ش��������⣺
(1)E�Ľṹ��ʽΪ ___��G������Ϊ_____
(2)B�к��й����ŵ�����Ϊ_______��
(3)C-D�ķ�Ӧ����Ϊ ___��
(4)д�� F+H��M�Ļ�ѧ��Ӧ����ʽ____��
(5)�����廯����W������ȡ��������C��ͬ���칹�壬����FeCl3��Һ������ɫ��Ӧ�� 0.5 molW����������Na��Ӧ����1gH2��H�˴Ź���������ʾΪ����壬��������������W��ͬ���칹�干��___ �֣�д������һ�ֵĽṹ��ʽ____��
(6)���������ϳ�·�ߣ���CH2=CH2��HOCH2CH2OHΪԭ�ϣ����Լ���ѡ��������Ʊ�![]() �ĺϳ�·��________��
�ĺϳ�·��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��IJ�������ȷ���ǣ� ��
A.��Һʱ����Һ©���ڵ��ϲ�Һ��Ӧ���Ͽڵ���
B.�ü��ȷֽ�ķ�������̼���ƺ��Ȼ������ֹ���
C.��������������Һ��ȥ����������ʱ�����ò���������
D.ij��Һ�м��������ữ����������Һ��������ɫ����������Һ�к���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص���ʵ�˵����ȷ���ǣ� ��
A.ǿ����ʵ���Һһ����������ʵ���Һ������ǿ
B.ǿ����ʵ���Һ��ֻ������������
C.���ӻ����ﶼ��ǿ����ʣ���������ʶ��ǹ��ۻ�����
D.�������ᱵ������ˮ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
��1����������O2��O3�������Ӹ�����Ϊ �� ԭ�Ӹ�����Ϊ �� ���ӵ����ʵ���֮��Ϊ ��
��2�����µ�ѹ�£��������O2��O3�������Ӹ�����Ϊ �� ԭ�Ӹ�����Ϊ �� ������Ϊ ��
��3����NAΪ����٤����������ֵ�����a gij�����к��еķ�����Ϊb����c g�������ڱ�״���µ����Լ�� ���ú�NA��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO42-����ɳ���ɽ���������ˮ��Ȼ�����������������������ˣ����� ����NaOH��Һ�������������ᣬ���ӹ���Na2CO3��Һ�����ӹ���BaCl2��Һ����ȷ�IJ���˳���ǣ� ��
A.�ڢ٢ܢݢ�B.�ܢڢݢ٢�C.�ڢݢܢ٢�D.�ݢڢ٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��������֮����ͼ��ʾ��ת����ϵ��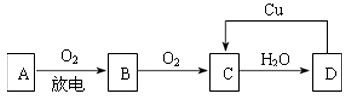
��֪��A�ǿ����е���Ҫ�ɷ֣�B��C��D��Ϊ�������CΪ����ɫ���壮
��ش��������⣺
��д��A��C�Ļ�ѧʽ��A �� C ��
��B��C�۲쵽�������� ��
��C��D�Ļ�ѧ��Ӧ����ʽ�� �� �÷�Ӧ���������� �� ��ԭ���� ��
����ͼʾD��C�Ĺ����з�����Ӧ�Ļ�ѧ����ʽ�� �� ���У�D���ֳ�ǿ��������ԡ���ԭ�ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��HR ��ʾ)��һ�ָ�Ч������������һ��Ũ�ȵ���������Һȥ��ˮ������Һ��H3R��H2R-��HR2-��R3-�ĺ�����pH�ı仯��ͼ��ʾ������˵����ȷ����
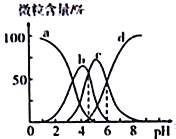
A. H3R�ĵڶ������볣��Ka2(H3R)��������Ϊ10-4
B. pH=6ʱ��c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR��Һ��HR2-��ˮ��̶ȴ��ڵ���̶�
D. pH=4ʱ��c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com