
| A. | H2、CH4在负极失去电子,发生氧化反应 | |
| B. | 从产物推断,两种燃料电池的氧化剂均为O2 | |
| C. | 燃料电池将化学能直接转变为电能,能量转化率高 | |
| D. | 分别将1 mol H2与1 mol CH4做燃料电池的燃料,转移的电子一样多 |
分析 燃料原电池中,燃料失电子发生氧化反应,所以通入燃料的电极为负极,负极上失电子发生氧化反应,通入氧化剂的电极为正极,正极上得电子发生还原反应,注意燃料电池也属于原电池.
解答 解:A.燃料原电池中,燃料失电子发生氧化反应,所以通入燃料的电极为负极,即H2、CH4在负极失去电子,发生氧化反应,故A正确;
B.通入氧化剂的电极为正极,即氧气在正极上得电子发生还原反应,所以两种燃料电池的氧化剂均为O2,故B正确;
C.燃料电池也是原电池,所以燃料电池实现了化学能转变为电能,能量转化率高,故C正确;
D.将1 mol H2和CH4做燃料电池的原料,甲烷和氢气失去的电子不同,所以转移的电子不同,故D错误;
故选D.
点评 本题考查燃料电池的工作原理,题目难度不大,注意把握两极反应的原理.


科目:高中化学 来源: 题型:选择题
| A. | 电子层结构相同的离子,随核电荷数的增大其离子半径逐渐减小 | |
| B. | 分子间作用力越强,则分子结构越稳定 | |
| C. | 失电子能力弱的原子得电子能力一定强 | |
| D. | 通过离子键形成的晶体属于离子晶体,通过共价键形成的晶体属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
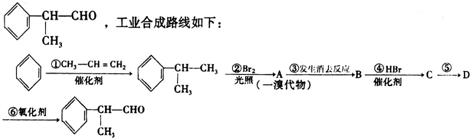
 或
或 .
. .
. +NaOH$→_{△}^{H_{2}O}$NaBr+
+NaOH$→_{△}^{H_{2}O}$NaBr+ ,其反应类型为取代反应.
,其反应类型为取代反应. (或
(或 ).
). 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶吸附能力很强,常用作袋装食品、瓶装药品的干燥剂 | |
| B. | 氧化铝熔点很高,可用来制作耐火坩埚及耐高温实验仪器 | |
| C. | 二氧化硫能使品红溶液褪色,将氯气通入二氧化硫的饱和溶液中可增强其漂白性 | |
| D. | 硅导电性介于导体和绝缘体之间,是良好的半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com