
石油裂化的主要目的是为了
A.提高轻质液体燃料的产量
B.便于分馏
C.获得短链不饱和气态烃
D.提高汽油的质量
科目:高中化学 来源: 题型:
已知:(1)Fe2O3(s) +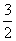 C(s)===
C(s)===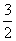 CO2(g)+2Fe(s) ΔH1=+234.1 kJ·mol-1
CO2(g)+2Fe(s) ΔH1=+234.1 kJ·mol-1
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
则2Fe(s)+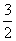 O2(g)===Fe2O3(s) 的ΔH是( )
O2(g)===Fe2O3(s) 的ΔH是( )
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42- 最合适的实际是Ba( NO3)2
NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度zxxk
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了3种燃煤烟气脱硫方法的原理。
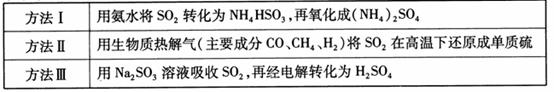
(1) 方法Ⅰ中氨水吸收燃煤烟气中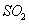 的化学反应为:
的化学反应为:
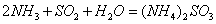
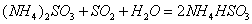
能提高燃煤烟气中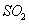 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D. 通入空气使 转化为
转化为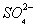
采用 方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的
方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的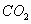 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
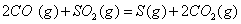
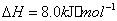
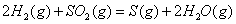

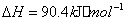
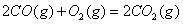
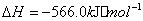
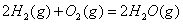
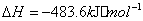
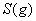 与
与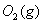 反应生成
反应生成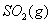 的热化学方程式为 。
的热化学方程式为 。
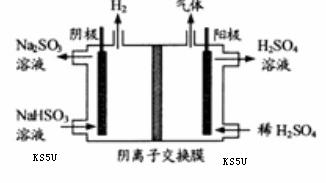
(3) 方法Ⅲ中用惰性电极电解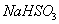 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为  。
。
(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
查看答案和解析>>
科目:高中化学 来源: 题型:
某物质E可做香料,其结构简式为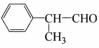 ,工业合成路线如下:
,工业合成路线如下:
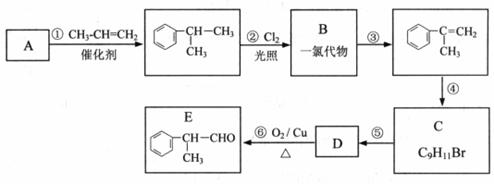
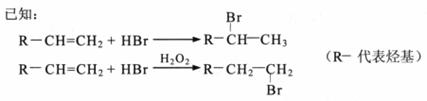
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____________(填序号);
A. 密度比水大 B. 所有原子均在同一平面上 C. 一氯代物只有一种
(2)B的结构简式可能是____________、____________;
(3)步骤④的化学方程式是________________________;
(4)E有多种同分异构体,写出符合以下条件的结构简式____________(只写反式结构)。
①具有顺反结构 ②能与NaOH溶液反应 ③分子中苯环上的一溴代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
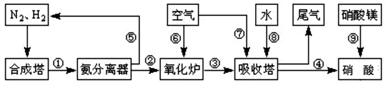
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
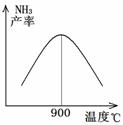
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com