
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
分析 A.硝酸具有强氧化性,与金属反应不产生氢气;
B.浓HNO3与浓HCl按1:3体积比所得的混合物叫王水;
C.硝酸为氧化性酸,与金属反应时,硝酸根表现强的氧化性;
D.浓硝酸具有强的氧化性,常温下遇Fe片发生钝化.
解答 解:A.硝酸具有强氧化性,与金属反应不产生氢气,故A错误;
B.浓HNO3与浓HCl按1:3体积比所得的混合物叫王水,故B错误;
C.硝酸为氧化性酸,与金属反应时,硝酸根表现强的氧化性,故C正确;
D.常温下,向浓HNO3中投入Fe片,发生钝化,不会产生大量的红棕色气体,故D错误.
故选C.
点评 本题考查了硝酸的性质,把握硝酸具有强的氧化性,是氧化性酸是解题关键,注意王水的组成.


科目:高中化学 来源: 题型:解答题
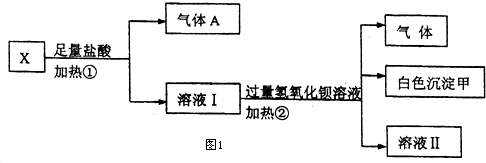
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. 按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸.
按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸. .试剂c最好选用C(填字母序号).
.试剂c最好选用C(填字母序号). .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com