
【题目】如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是a mol,久置后其气体的物质的量是b mol,其中a≥b的是
X | Y |
| |
A | 少量C、Fe屑 | NaCl溶液 | |
B | 过量Na2SO3粉末 | 稀H2SO4 | |
C | 少量Fe块 | 浓H2SO4 | |
D | 过量Cu粉末 | 浓HNO3 |
A. A B. B C. C D. D
【答案】C
【解析】
若锥形瓶内气体的最大物质的量是amol,久置后其气体的物质的量是bmol,如存在 a>b关系,说明在久置过程中锥形瓶的气体参与反应而消耗,反之不存在a>b,以此解答该题。
A.铁与盐酸反应生成氢气,因为铁过量,则久置过程中铁发生吸氧腐蚀,则消耗氧气, a>b,故A不选;
B.亚硫酸钠和稀硫酸反应生成二氧化硫气体,因为亚硫酸钠过量,则久置过程中亚硫酸钠与二氧化硫反应生成亚硫酸氢钠,气体总物质的量减小, a>b,故B不选;
C.Fe、Al与浓硫酸发生钝化,气体体积基本不变,故C选;
D.铜和浓硝酸反应生成二氧化氮气体,久置过程中二氧化氮与水反应生成NO,体积变小,故D不选;
综上所述,本题选C。


科目:高中化学 来源: 题型:
【题目】已知亚硫酸钠隔绝空气加热到 600℃可以分解,实验流程如下图(所得气体是纯净物):
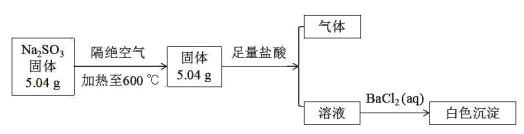
(1)硫元素在元素周期表中的位置_________________亚硫酸钠中含有的化学键类型 _________________ .
(2)写出亚硫酸钠受热分解的化学方程式 _________________ .
(3)下列说法正确的是 _________________ .
A.加热分解后的固体中氧元素质量为 1.92 克
B.生成白色沉淀的物质的量 0.04mol
C.分解后固体溶于水后,溶液中离子浓度大小顺序为c(Na+)> c(SO42-)>c(S2-)>c(OH-)>c(HS-)>c(H+)
D.将适量亚硫酸钠与分解后的固体混合,再加稀盐酸可能会出现沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在A中放入干燥的细铜丝,左边烧杯中放入热水,试管B中放入乙醇,右边试管C中放入冷水。向B中不断鼓入空气,使乙醇蒸气和空气通过加热至红热的铜丝。
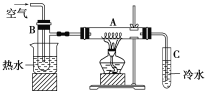
(1)A的名称为________,热水的作用是____________,本实验的目的是__________。
(2)检验乙醇中是否有水的方法为_____________,除去其中水的方法为__________;撤去A处酒精灯后铜丝仍能保持红热的原因是____________________________。
(3)反应后将试管C中的液体冷却,取出少量,滴加几滴银氨溶液,再水浴加热一段时间观察到的现象为_________________;反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 10g质量分数为46%的乙醇溶液中,氢原子的总数约为0.6NA
B. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
C. 将1L 0.1mol·L1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,NH![]() 数目:1L 0.5mol·L1 NH4Cl溶液大于2L 0.25mol·L1 NH4Cl溶液
数目:1L 0.5mol·L1 NH4Cl溶液大于2L 0.25mol·L1 NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚—A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
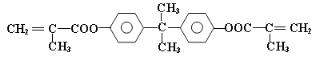
它在一定条件下水解可生成双酚—A和羧酸H两种物质。
I.(1)双酚—A的分子式为____________。下列有关它的叙述中正确的是________。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有13个碳原子在同一平面上
D.1mol 双酚—A与溴水反应,最多消耗Br2的物质的量为4mol
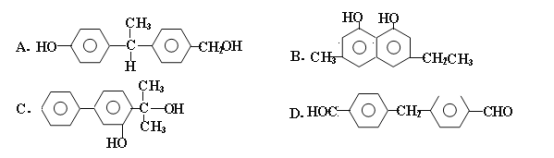
(2)下列物质中与双酚—A互为同分异构体的是_________(填序号)。
II.已知醛能被催化氧化为羧酸。
![]()
羧酸H可以由以下途径制得(有的反应条件没有标出):
![]()
(3)C的结构简式为__________________。
(4)G中所含官能团为____________(填名称),G→H的反应类型为__________。
(5)E→F的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO ![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H________0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________________。
(3)假设在密闭容器中发生上述反应,投入相等的反应物,反应刚开始时下列措施能提高NO反应速率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,催化剂比表面积会影响化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在下表中填入剩余的实验条件数据。
实验 编号 | T/℃ | NO初始浓度 mol·L-1 | CO初始浓度 mol·L-1 | 催化剂的比表面积 m2·g-1 | 达到平衡的时间 分钟 |
Ⅰ | 280 | l.20×10-3 | 5.80×10-3 | 82 | 200 |
Ⅱ | l.20×10-3 | 124 | 120 | ||
Ⅲ | 350 | 5.80×10-3 | 124 | 5 |
通过这3组实验,可以得出的温度、催化剂比表面积对化学反应速率的影响规律是___________________________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com