
| A��Cl2 | B��H2O2 | C��ClO2 | D��O3 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe2+��Na+��NO3-��Cl- | B��Ba2+��Na+��NO3-��Cl- |
| C��SO42-��SO32-��NH4+��Na+ | D��Mg2+��Na+��Br-��ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na+��CO32-��Ca2+��NO3- | B��Na+��NO3-��Al3+��Cl- |
| C��K+��SO42-��Cl-��Cu2+ | D��Ba2+��Cl-��K+��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ѡ�� | ������ | �����Լ� | �����Լ�������Ӧ�����ӷ���ʽ |
| A | Fe2+��NO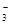 ��K+ ��K+ | ϡ���� | 3Fe2++NO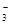 +4H+��3Fe3++NO��+2H2O +4H+��3Fe3++NO��+2H2O |
| B | Fe3+��I����ClO�� | ����������Һ | Fe3++3OH����Fe��OH��3�� |
| C | Ba2+��HCO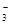 ��Cl�� ��Cl�� | ����������Һ | HCO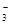 + OH����CO + OH����CO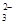 +H2O +H2O |
| D | Al3+��Cl����NO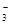 | ��������������Һ | Al3++3 OH����Al��OH��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
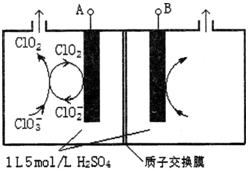
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ������ | NH4+��Na����Mg2�� |
| ������ | OH����NO3����SO42�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A���Լ�����AgNO3��Һ���Լ�����HNO3������1�а�ɫ������AgCl |
| B������3�а�ɫ������BaSO4 |
| C����������2�����ӷ���ʽ��Br2��2H2O��SO2=4H����2Br����SO42�� |
| D���Լ��������ᣬ�Լ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��Br2>I2 | B��Fe3��>Br2 |
| C��Br2>Fe3�� | D��I��>Br�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com