
 N2O4(g) ��H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ��һ�ݻ�Ϊ2 L���ܱ������У���Ӧ��Ũ����ʱ��仯
N2O4(g) ��H��0���ں��������½�һ����NO2��N2O4�Ļ������ͨ��һ�ݻ�Ϊ2 L���ܱ������У���Ӧ��Ũ����ʱ��仯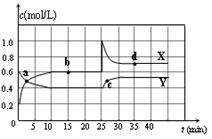
| A��ͼ�е��������ߣ�X�DZ�ʾNO2Ũ����ʱ��ı仯���� |
| B��ǰ10 min����v(NO2)��ʾ�Ļ�ѧ��Ӧ����Ϊ0.06 mol/(L��min) |
| C��25 minʱ������ƽ���ƶ���ԭ���ǽ��ܱ������������СΪ1L |
| D��a��b��c��d�ĸ����У�ֻ��b��d��Ļ�ѧ��Ӧ����ƽ��״̬ |
 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C
2C| A���� | B���� |
| C���� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 AB2(g)���ֱ���ijʱ�̲������AB3��ռ������������ͼ������ȷ��������
AB2(g)���ֱ���ijʱ�̲������AB3��ռ������������ͼ������ȷ��������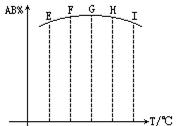
| A����Ӧ�Ƿ��ȷ�Ӧ |
| B��E��F������δ�ﵽƽ��״̬ |
| C��H��I������δ�ﵽƽ��״̬ |
| D��G��H��I���㹦���Ѵ�ƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ƽ��������Ӧ�����ƶ��� | B������A��ת���ʼ�С�� |
| C������B���������������� | D��a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(g)+H2(g)��һ��ʱ���Ӧ�ﵽƽ�⡣�Ը�ƽ��״̬������ȷ����
CO2(g)+H2(g)��һ��ʱ���Ӧ�ﵽƽ�⡣�Ը�ƽ��״̬������ȷ����| A������Ӧ���ʵ����� | B������Ӧ���ʴ����淴Ӧ���� |
| C������Ӧ���ʵ����淴Ӧ���� | D������Ӧ����С���淴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC(g)��dD(g)����H��0���ﵽ��ѧƽ��ʱ���������¶Ȼ�ѹǿ������ʹC�����ʵ������������и����ϵ��ȷ���ǣ� ����
cC(g)��dD(g)����H��0���ﵽ��ѧƽ��ʱ���������¶Ȼ�ѹǿ������ʹC�����ʵ������������и����ϵ��ȷ���ǣ� ����| A��a��b��c��d����H��0 | B��a��b��c��d����H��0 |
| C��a��b��c��d����H��0 | D��a��b��c��d����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��K��1 | B��K��10 | C��K��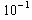 | D��K��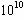 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
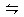 2NH3��g����
2NH3��g����| A������6mol | B������6mol |
| C��С��6mol | D�����ܴ��ڡ�С�ڻ����6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 bZ(g)
bZ(g)| A��a=1,b="1" | B��a=2,b="1" |
| C��a=2,b="2" | D��a=3,b=2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com