
【题目】氯化钴(CoCl2)可溶于水,常用作湿度和水分的指示剂,工业上也可用于制取钴。
(1)钴元素的常见化合价与铁元素相同。往CoCl2溶液中加入NaOH溶液产生粉红色沉淀,露置于空气中一段时间后,沉淀变为棕褐色。
① 化合态钴的常见化合价有_______。
② 沉淀由粉红色变为棕褐色反应的化学方程式为_______________。
(2)将CoCl2溶于浓盐酸中能形成[CoCl4]2-,溶液中存在平衡:[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
T1℃时,将0.025mol CoCl2·6H2O溶于50mL 12mol/L浓盐酸中,再加水稀释至100 mL。溶液中c(Cl-)与温度(T)的关系如右图所示。

① Tl ℃时,取10mL上述溶液稀释至l00mL,稀释后的溶液中c(Cl-)______0.6mol·L-1(填“>”“=”或“<”)。
② 由图可知,上述反应的△H______0(填“>”“=”或“<”)。
③ 根据A点数据,计算出T1℃时上述反应的平衡常数为________。
(3)采用下图所示装置(Ti-Ru电极为惰性电极)电解CoCl2溶液制取钴。Co能与强酸反应产生H2,不利于Co的沉积,故电解过程中,CoCl2溶液的pH通常控制在3.9~4.2。

① Co沉积在_______(填“Ti-Ru”或“Ti”) 电极上。
② CoCl2溶液中常含有少量Cu2+、Fe3+、Na+等,为提高产品的纯度和电流效率,电解前必须将其中的_______(填离子符号)除去。
③ 若用CoSO4溶液代替CoCl2溶液,会使产率降低。其原因是_____________。
【答案】 +2、+3 4Co(OH)2+2H2O+O2=4Co(OH)3 > > 7.72×10-4(mol/L)-4 Ti Cu2+、Fe3+ OH-在阳极放电,使溶液的pH降低
【解析】(1)①钴元素的常见化合价与铁元素相同,因此化合态钴的常见化合价有+2、+3价。②沉淀由粉红色变为棕褐色,说明+2价Co被氧化为+3价,反应的化学方程式为4Co(OH)2+2H2O+O2=4Co(OH)3。(2)①Tl ℃时,取10mL上述溶液稀释至l00mL,稀释向逆反应方向进行,则稀释后的溶液中c(Cl-)>0.6mol·L-1。②由图可知,升高温度氯离子浓度降低,则升高温度平衡向正反应方向进行,所以上述反应的△H>0。③根据方程式可知
[Co(H2O)6]2++4Cl-![]() [CoCl2]2-+6H2O
[CoCl2]2-+6H2O
起始浓度(mol/L) 0.25 6.5 0
转化浓度(mol/L) 0.125 0.5 0.125
平衡浓度(mol/L) 0.125 6 0.125
因此T1℃时上述反应的平衡常数为![]() 。
。
(3)①Co2+在阴极得到电子,Ti电极与电源负极相连,是阴极,因此Co沉积在Ti电极上。②Co能与强酸反应产生H2,说明金属性较强,因此Cu2+、Fe3+的氧化性强于Co2+,所以电解前必须将其中的Cu2+、Fe3+除去。③若用CoSO4溶液代替CoCl2溶液,OH-在阳极放电,使溶液的pH降低,导致产率降低。


科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式______________________。
⑵NH2-的电子式为_______________。
⑶N3-有________个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式_____、____。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型___________________。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)![]() CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
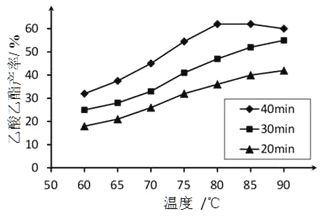
①该研究小组的实验目的是________________。60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是___________;
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入__________溶液进行充分洗涤,分离出有机层,并加入无水硫酸钠干燥,最后经过__________、_______两步操作即可得到纯品。
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式_____________________;
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=________(单位省略,计算结果保留两位有效数字),其溶液中c(H2C2O4)________c(C2O42-)(填“小于”、“等于”或“大于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是H2(g)+Cl2(g)=2HCl(g)反应过程中的能量变化图。

(1)由图可知,1 mol H2(g)和1 mol Cl2(g)的总能量____(填“>”、“<”或者“=”) 2 mol HCl(g)的能量。
(2)该反应是___________(填“吸”或者 “放”)热反应,从化学键的角度进行解释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法错误的是( )
A.热稳定性:HCl>H2S
B.原子半径:N>O
C.结合质子能力:S2﹣>Cl﹣
D.酸性:H2SO3>H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线 a 和 b 是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是 ( )。
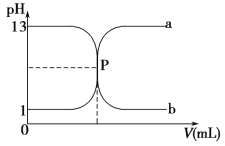
A.盐酸的物质的量浓度为 1 mol·L-1
B.P 点时恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修5:有机化学基础】
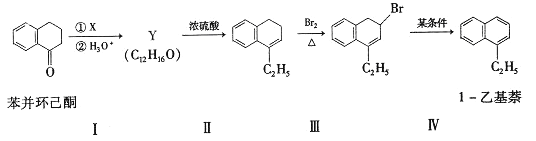
苯并环己酮是合成萘(![]() )或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示:
)或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示:
己知: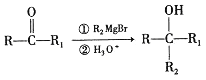
回答下列问题:
(l)萘的分子式为_______;苯并环己酮所含官能团是_______(填名称)。
(2)Y的结构简式为_________。
(3)步骤Ⅲ的反应属于_________(填反应类型)。
(4)步骤Ⅳ反应的化学方程式为____________(标明反应条件)。
(5)苯并环己酮用强氧化剂氧化可生成邻苯二甲酸。邻苯二甲酸和乙二醇经缩聚反应生成的高分子化合物的结构简式是________。
(6)1-乙基萘的同分异构体中,属于萘的取代物的有_______种(不含1-乙基萘)。W也是1 -乙基萘的同分异构体,它是含一种官能团的苯的取代物,核磁共振氢谱显示W有三种不同化学环境的氢原子,且个数比为1:1:2,W的结构简式为_________。
(7)仍以苯并环己酮为原料,上述合成路线中,只要改变其中一个步骤的反应条件和试剂,便可合成萘。完成该步骤:__________(表示方法示例:A ![]() B)。
B)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,可逆反应N2+3H2 ![]() 2NH3已达到平衡,下列有关说法中正确的有( )
2NH3已达到平衡,下列有关说法中正确的有( )
①1个N≡N键断裂的同时,有3个H—H键形成 ②反应混合物中各组分的体积分数保持不变 ③N2 H2的转化率一定相等 ④1个N≡N键断裂的同时,有6个N—H 键形成 ⑤气体的平均相对分子质量不再改变 ⑥N2 H2 NH3的物质的量之比一定为1∶3∶2,
A. ①②⑤ B. ①②④⑤ C. ③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com