
| A. | 原子半径:O<S<Na | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 电负性:P<S<Cl | D. | 第一电离能:Na<Al<Mg |
分析 A.同周期元素原子半径依次减小,同主族从上到下依次增大;
B.元素的非金属性越强,其气氢化物的热稳定性越强;
C.元素的非金属性越强,电负性越强;
D.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
解答 解:A.同周期元素原子半径依次减小,同主族从上到下依次增大,所以半径:O<S<Na,故A正确;
B.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:N>S>P,所以稳定性PH3<H2S<NH3,故B错误;
C.元素的非金属性越强,电负性越强,元素的非金属性:P<S<Cl,所以电负性P<S<Cl,故C正确;
D.同一周期元素的第一电离能随着原子序数的增大而增大,同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能Na<Al<Mg,故D正确;
故选B.
点评 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.


科目:高中化学 来源: 题型:选择题
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Ca2+、Ag+ | B. | Ba2+、Ag+、Ca2+ | C. | Ag+、Ba2+、Ca2+ | D. | Ag+、Ca2+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
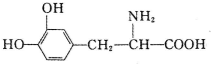
| A. | 常温下,不溶于水 | B. | 既可与酸反应,又可与碱反应 | ||
| C. | 遇FeCl3溶液无变化 | D. | 与溴水混合,溴水褪色,溶液分两层 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: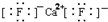 | D. | 中子数为10的氧原子:${\;}_8^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉 聚异戊二烯 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 纤维素 涤纶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com