
| A.1∶1 | B.2∶1 | C.1∶2 | D.1∶3 |
科目:高中化学 来源:不详 题型:填空题

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
| A.NaOH | B.CuO | C.Cu(OH)2 | D.NH3·H2O E.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a/22.4 mol |
| B.a/11.2 mol |
| C.3a/22.4 mol |
| D.3amol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性 |
| B.还原性 |
| C.导电性 |
| D.导热性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶7 | B.7∶2 |
| C.5∶2 | D.2∶5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| c(H+) | c(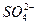 ) ) | c(Fe2+、Fe3+) |
| | | |
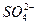 )的关系。
)的关系。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、Fe2+ |
| B.Cu2+、Fe2+、Fe3+ |
| C.Cu2+、Fe3+ |
| D.Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是
中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无变化,下面结论正确的是| A.不溶物一定是铜 | B.不溶物一定是铁  |
C.不溶物 中一定含铜,但不一定含铁 中一定含铜,但不一定含铁 | D.溶液中一定含有FeSO4,可能含有CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com