
| A. | 都正确 | B. | ②③④⑤ | C. | ②③⑤ | D. | ②④⑤ |
分析 ①能和水反应只生成碱的氧化物是碱性氧化物,发生的反应为复分解反应;
②Na2CO3溶液和NaHCO3溶液与Ca(OH)2溶液反应生成碳酸钙沉淀;
③钠在常温下易被氧化,加热杯氧化生成过氧化钠;
④Na2O2能与二氧化碳反应生成碳酸钠和氧气,而Na2O与二氧化碳反应生成碳酸钠;
⑤碳酸钠和碳酸氢钠都是强碱弱酸盐,碳酸根离子、碳酸氢根离子水解溶液显碱性;
解答 解:①Na2O和水反应只生成碱,是碱性氧化物,Na2O2和水反应生成氢氧化钠和氧气,发生氧化还原反应,不是碱性氧化物,故①错误;
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀,Ca2++CO32-=CaCO3↓,Ca2++OH-+HCO3-=CaCO3↓+H2O,②正确;
③钠在常温下易被氧化生成白色固体氧化钠,加热反应生成淡黄色固体过氧化钠,故③错误;
④Na2O2能与二氧化碳反应生成碳酸钠和氧气,而Na2O与二氧化碳反应生成碳酸钠,所以Na2O2可作供氧剂,而Na2O不行,故④正确;
⑤碳酸为弱酸,Na2CO3溶液和NaHCO3溶液都是强碱弱酸盐溶液,碳酸氢钠溶液中碳酸氢根离子水解程度大于电离程度,碳酸根离子和碳酸氢根离子水解溶液都呈碱性,故⑤正确;
故选D.
点评 本题主要考查了物质的性质与用途,主要是那及其化合物性质的应用,难度不大,根据所学知识即可完成.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为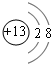 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量的气体,其气体摩尔体积也相同 | |
| B. | 气体摩尔体积是指1mol任何气体所占的体积为22.4L | |
| C. | 标准状况下的气体摩尔体积约为22.4L/mol | |
| D. | 一定物质的量的气体所占的体积就是气体摩尔体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe( N03)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+20H-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com