解:(一)由硫酸试剂瓶标签上的内容可知,该浓硫酸密度为1.84g/ml,质量分数为98%.
所以浓H
2SO
4的物质的量浓度c=
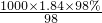
mol/L=18.4mol/L.
故答案为:18.4mol/L.
(二)(1)容量瓶没有240ml规格,选择体积相近的容量瓶,故应用250ml的容量瓶.
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×0.46mol/L,解得:x≈6.3.
故答案为:6.3.
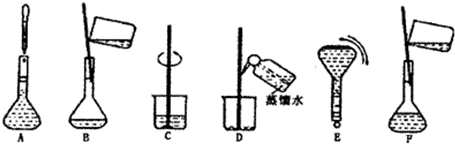
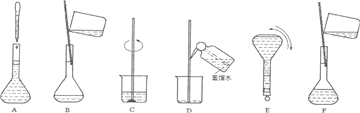
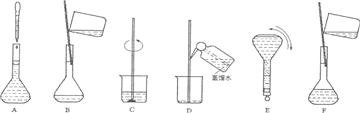
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以必须用的仪器为:①烧杯、③250mL容量瓶、⑤玻璃棒、⑦10mL量筒、⑧胶头滴管.
故答案为:①③⑤⑦⑧
(3)由(2)中操作步骤可知,实验过程先后次序排列CBDFAE.
故答案为:CBDFAE.
(4)该同学实际配制得到的浓度为0.45mol/L,所配溶液浓度偏低.
A.量取浓H
2SO
4时仰视刻度,量取的浓硫酸的体积增大,所配溶液浓度偏高;
B.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
C.没有将洗涤液转入容量瓶,转移到容量瓶中溶质硫酸的物质的量减小,所配溶液浓度偏低;
D.定容时仰视刻度,使溶液的体积偏大,所配溶液浓度偏低;
故选:CD.
分析:(一)根据c=

计算浓H
2SO
4的物质的量浓度.
(二)(1)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积.
(2)根据配制溶液的操作步骤选择所用仪器;
(3)据配制溶液的实验操作过程进行实验步骤排序.
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
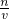
分析判断.
点评:本题考查了一定物质的量浓度溶液的配制,注意从c=
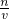
理解配制原理,注意操作顺序排序中容量瓶中溶液体积多少确定BF位置.


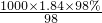 mol/L=18.4mol/L.
mol/L=18.4mol/L. 计算浓H2SO4的物质的量浓度.
计算浓H2SO4的物质的量浓度.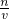 分析判断.
分析判断.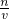 理解配制原理,注意操作顺序排序中容量瓶中溶液体积多少确定BF位置.
理解配制原理,注意操作顺序排序中容量瓶中溶液体积多少确定BF位置. 

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案