
| H2SO4浓 |
| 140℃ |

| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


科目:高中化学 来源: 题型:
2CH3CH2OH![]() CH3CH2—O—CH2CH3+H2O
CH3CH2—O—CH2CH3+H2O
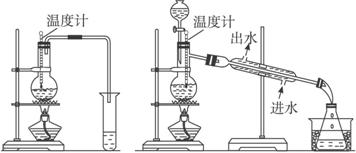
甲 乙
(1)图甲与图乙是两套实验室制乙醚的装置,选装置________________最合适,理由是____________________________________________________________________。
(2)反应液中应加入沸石,其作用是_____________________________________________。
(3)反应中温度计的位置是___________________________________________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是_____________,除去这种杂质的简易方法是__________________________________________________________________。
(5)如果温度太高将会出现_____________反应,产物是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇的沸点是78 ℃,能与水任意比例混溶,乙醚的沸点是34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的原理是:
2CH3CH2OH![]() CH3CH2—O—CH2CH3+H2O
CH3CH2—O—CH2CH3+H2O
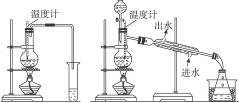
甲 乙
(1)图甲与图乙是两套实验室制乙醚的装置,选装置________________最合适,理由是______________________________________________________________________________。
(2)反应液中应加入沸石,其作用是_____________________________________________。
(3)反应中温度计的位置是___________________________________________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是_____________,除去这种杂质的简易方法是__________________________________________________________________。
(5)如果温度太高将会出现_____________反应,产物是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
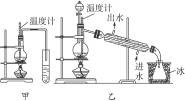
图6-3
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,
难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的
反应原理是

(1) 图甲和乙是两套实验室制乙醚的装置,选装置 最合适。
(2)反应液中应加入沸石,其作用是 。
(3)反应中温度计的位置是 。
(4)用装置乙制得的乙醚中可能含有大量的乙醇,除去乙醇的简易方法是 。
(5) 如果温度太高将会发生另一有机反应,此反应方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com