
| A. | v(O2)=0.02mol•L-1•min-1 | B. | v(SO3)=0.04mol•L-1•min-1 | ||
| C. | v(SO2)=0.02mol•L-1•min-1 | D. | v(SO3)=0.01mol•L-1•min-1 |
分析 在一定条件下,反应2SO2+O2?2SO3在2L密闭容器中进行,5min内SO3的质量增加了16.0g,物质的量=$\frac{16.0g}{80g/mol}$=0.2mol,三氧化硫表示的反应速率v(SO3)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),依据反应速率之比等于化学方程式计量数之比计算其他物质的反应速率判断;
解答 解:5min内SO3的质量增加了16.0g,物质的量=$\frac{16.0g}{80g/mol}$=0.2mol,三氧化硫表示的反应速率v(SO3)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02mol/(L•min),反应速率之比等于化学方程式计量数之比,
A.v(O2)=$\frac{1}{2}$v(SO3)=0.01mol•L-1•min-1 ,故A错误;
B.v(SO3)=0.02mol•L-1•min-1,故B错误;
C.v(SO2)=v(SO3)=0.02mol•L-1•min-1 ,故C正确;
D..v(SO3)=0.02mol•L-1•min-1,故D错误;
故选C.
点评 本题考查了化学反应速率的概念分析计算,主要是反应速率之比等于化学方程式计量数之比的计算应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
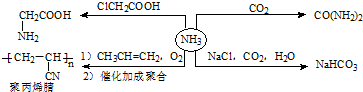
| A. | H2NCH2COOH是一种氨基酸 | |
| B. | CO(NH2)2与NH4CNO性质相同 | |
| C. | 聚丙烯腈的单体为:CH2═CHCN | |
| D. | 依据酸碱质子理论,HCO3-属于酸碱两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以利用丁达尔效应区别胶体和溶液 | |
| B. | 往醋酸溶液中通入足量氨气溶液导电能力变强 | |
| C. | 往FeCl3饱和溶液中逐滴加入浓NaOH溶液边滴加边振荡,可以制得Fe(OH)3胶体 | |
| D. | 丙烯醛(结构简式为CH2═CH-CHO)在一定条件下与H2充分反应生成1-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
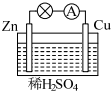 如图所示是 Zn和 Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
如图所示是 Zn和 Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )| A. | ①②③ | B. | ②④⑥ | C. | ③④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Q | ||||
| Y |
| A. | Q的最高价氧化物属于离子化合物 | |
| B. | W和氢元素组成的化合物分子中只含有极性共价键 | |
| C. | Q、X、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 | |
| D. | 工业上可用电解熔融的X的氯化物方法来制备X单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
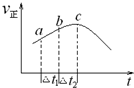 (1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).
(1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL,1mol•L-1 的NaCl | B. | 100mL,2mol•L-1 的MgCl2 | ||
| C. | 100mL,1mol•L-1 的FeCl3 | D. | 50mL,3mol•L-1 的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
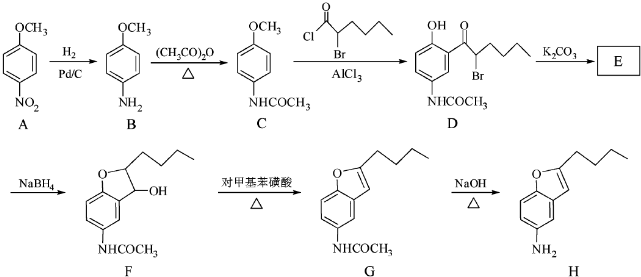
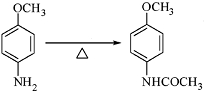 +CH3COOH
+CH3COOH .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com